下列关于甲烷的叙述正确的是
| A.甲烷分子的空间构型是正四面体型,所以,CH2Cl2有两种不同构型 |
| B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色 |
| C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一 |
| D.将甲烷与氯气以体积比1:1的比例混合,光照条件下就可得到比较纯净的CH3Cl |
在密闭容器中的一定量的混合气体发生如下反应:aA(g)+bB(g)  cC(g)+dD (g)
cC(g)+dD (g)
平衡时测得A的浓度为0.5mol/L,保持温度不变,将体积压缩为原来的1/2,在达到平衡时,测得A的浓度为0.8mol/L,则下列说法正确的是:()
| A.a+b<c+d | B.平衡正向移动 | C.B的转化率降低 | D.C的体积分数降低 |
T ℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z 的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是()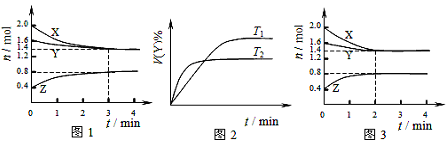
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.图1 反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L·min) |
| C.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
| D.保持其他条件不变,升高温度,化学平衡向逆反应方向移动 |
根据下列热化学方程式:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+1/2O2(g)=H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为()
| A.ΔH=+244.1kJ/mol | B.ΔH=-488.3kJ/mol |
| C.ΔH=-996.6kJ/mol | D.ΔH=+996.6kJ/mol |
已知2SO2(g)+O2(g) 2SO3(g)△H=-197kJ/mol。在25℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是()
2SO3(g)△H=-197kJ/mol。在25℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量a1;若25℃时在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2,达到平衡时放出热量a2。则下列关系正确的是()
| A.2a2=a1="197" kJ | B.197 kJ> a1=2a2 | C.a2>a1>197 kJ | D.2a2<a1<197 kJ |
在体积固定的密闭容器中进行可逆反应2NO2 2NO+O2,下列能作为反应达到平衡状态标志的是( )
2NO+O2,下列能作为反应达到平衡状态标志的是( )
①单位时间内生成nmol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变⑤混合气体的密度不再改变
⑥混合气体的压强不再改变⑦混合气体的平均相对分子质量不再改变
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |