现有七种元素,其中A、 B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息
B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息 ,回答问题。
,回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p 电子数比s电子数少1 电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1="738kJ/mol " I2 =" 1451" kJ/mol I3 =" 7733kJ/mol " I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)已知BA5 为离子化合物,写出其电子式 。
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈  形。
形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为: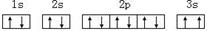
该同学所画的电子排布图违背了 。
(4)G位于 族 区。
(5)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为
(6)检验F元素的方法是 ,请用原子结构的知识解释产生此
现象的原因是 
。
(7)F元素的晶胞如右图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为 cm。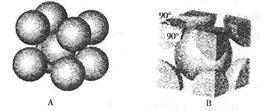
X、Y和W为原子序数依次递增的短周期元素。已知:X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”);若装置D中装的是铜粉,当通入足量W2时观察到的现象为;若装置D中装的是五氧化二钒(催化剂),当通入足量YX2时,打开K通入适量X2,化学反应方程式为 。
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是(填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |
工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线________(填:a或b)表示使用了催化剂;该反应属于________(填:吸热、放热)反应。
(2)下列说法正确的是________。
| A.起始充入的CO为1 mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1 mol CO和2 mol H2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡,v(H2)=________;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数________(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数________(填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
又知H2O(l)=H2O(g) ΔH=+44 kJ/mol,请写出32 g的CH3OH(g)完全燃烧生成液态水的热化学方程式
______________________________________________________________________。
(6)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出用Co3+除去甲醇的离子方程式 。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: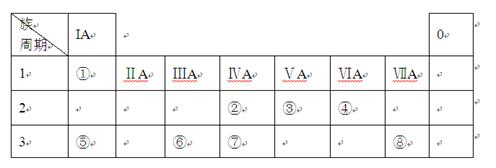
(1)⑤、⑥、⑦元素的原子半径由大到小的顺序为。 (2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是。
(2)②、③、⑦元素的最高价含氧酸的酸性由强到弱的顺序是。 (3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)。
(3)由表中两种元素的原子按1︰1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)。 a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4 (4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式。
(4)元素⑥的氯化物溶液与稀氨水溶液反应的离子方程式。
工业上冶炼单质⑥的反应原理。
(5)某无色稀溶液X含有四种阴离子,是由②④⑥⑦⑧元素中的一种或两种组成。现取该溶液适量,向其中加入稀盐酸,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
则oa段转化为沉淀的离子(指来源于X溶液,下同)是________,ab段发生反应的离子是________,bc段发生反应的离子方程式为_____________________________________。
在一容积为2 L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)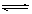 CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示:
CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如右图所示: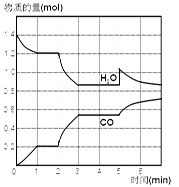
(1)反应处于平衡状态的时间区间是_____________。
(2)若反应进行到2 min时,改变了温度,使曲线发生如右图所示的变化,则温度为______(选填“升高”或“降低”),逆反应是____________(选填“吸”或“放”)热反应。
(3)反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示变化,该条件可能是下述中的_________________。
| A.增加了C | B.增加了水蒸气 | C.降低了温度 | D.增加了压强 |
现有一盛有无色固体物质M的试剂瓶,标签已破损(见图)。已知硫酸、盐酸、硝酸等是强酸,碳酸、氢硫酸、亚硫酸、醋酸等是弱酸,烧碱、苛性钾等是强碱,一水合氨等是弱碱。由强酸与强碱组成的正盐呈中性,由强酸弱碱组成的正盐呈酸性,由弱酸强碱组成的正盐呈碱性。
(1)若M的水溶液为中性,则实验室检验M中阴离子的离子方程式为_____________________________________。
(2)若M的水溶液呈碱性,加入过量盐酸后产生无色无味的气体,则产生的气体的化学式为_______________。
(3)若M置于空气中易被氧化为另一种物质,生成物的摩尔质量比M增加了16,则M的化学式为_______________。
(4)若M的水溶液呈碱性,加入过量盐酸后产生腐卵臭气味的气体,则M与盐酸反应后生成的气体在过量空气中燃烧的化学方程式为________________________。