(4分 )常温下,有pH=12的NaOH溶液10ml,要使它的pH降为11,
)常温下,有pH=12的NaOH溶液10ml,要使它的pH降为11,
(1)若加入蒸馏水,则加入蒸馏水的体积为___________ ml。
(2)若加入pH=3的HCl溶液,则加入HCl溶液的体积为_________________ ml。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题: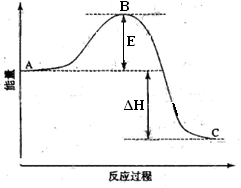
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是
(2)图中△H= KJ·mol-1
发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g)⊿ H1= + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g)⊿ H2 = - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O(g)⊿ H3= - 484kJ/mol;
H2(g)+F2(g)=2HF(g)⊿ H4= - 538kJ/mol
写出N2H4与 NO2反应的热化学方程式________________________________________,
写出N2H4与F2反应的热化学方程式__________________________________________。
已知H2 ( g ) + 1/2O2 ( g ) = 2H2O ( g ) ,反应过程中能量变化如下图: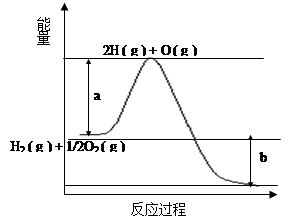
请回答下列问题:
(1)图中a,b分别代表什么意义?
a.;b.。
(2)该反应是反应(填“吸热”或“放热”),△H(填“< 0”或“> 0”)。
下图是一个电化学过程的示意图。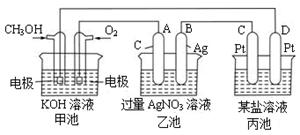
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为
(4)当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
| A.MgSO4溶液 | B.CuSO4溶液 | C.NaCl溶液 | D.AgNO3溶液 |
(12分)环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
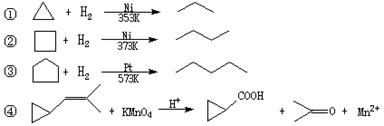
回答下列问题:
(1)写出与环丙烷不同类别但互为同分异构体的有机物的结构简式________________。
(2)反应①~③的反应类型是_______,其中最容易发生此类反应的环烷烃是(填名称)。
(3)环烷烃还可以与卤素单质、卤化氢发生类似①~③的反应,如环丙烷与Br2可在一定条件下发生反应,反应得到的产物键线式____________,该物质还有_______种同分异构体。
(4)要鉴别环己烷和己烯,方法是;