氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下: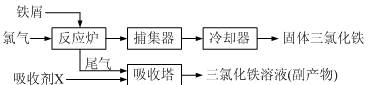
⑴取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片得红褐色氢氧化铁胶体,其离子方程式可表示为: ▲ ,胶体粒子的直径一般不超过 ▲ 。
⑵吸收塔中吸收剂X是 ▲ 。
⑶温度超过673 K,捕集器中的物质相对分子质量为325,该物质的分子式为 ▲ 。
⑷通常用碘量法测定FeCl3的质量分数:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL。则样品中氯化铁的质量分数为: ▲ 。
H是一种新型香料的主要成分之一,其结构中含有三个六元环。H的合成路线如下(部分产物和部分反应条件略去):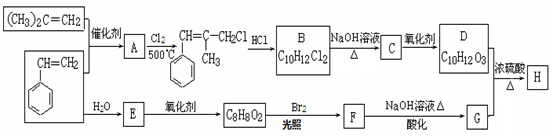
已知:①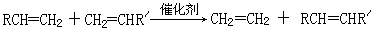
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)A→B反应过程中涉及的反应类型有、。
(2)生成A的化学方程式: 。
(3)D分子中含有的官能团名称:。
(4)E的分子式:。
(5)H的结构简式:。
(6)同时满足下列条件的G的同分异构体有种(不包括立体异构):
①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基。
其中核磁共振氢谱为5组峰的为(写结构简式)。
A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B,G。
(2)写出F的价电子排布图:。
(3)写出化合物BC的结构式:。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)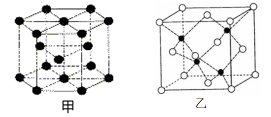
选修:化学与技术】(金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下: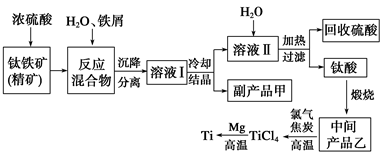
已知反应:①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)△TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O△TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法:。
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理______________________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示)。正确的检验方法是:取少量待测液,加入(写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因。
(5)将粗K2FeO4产品经重结晶、过滤、、,即得较纯净的K2FeO4。
已知;①Fe(s)+CO2(g)
 FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
②Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=b kJ·mol-1。
测得在不同温度下,K值如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)反应①为__________(选填“吸热”或“放热”)反应。
(2)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为。
(3)下列关于反应①的说法正确的是。
A.达到平衡后保持其他条件不变,升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B. 在500 ℃下反应,当c(CO2)=c(CO)时,反应达到平衡状态
C.恒温恒容下,当容器内气体密度不再变化时,反应达到平衡状态
D.加压、升温和使用催化剂均可增大反应物的转化率
(4)由已知反应,写出Fe2O3(s)被CO(g)还原成FeO(s)的热化学方程式。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1(已知:Ksp[Fe(OH)3]=4.0×10-36)。
(6)新型锌空电池与锂电池相比,具有能量密度高、安全性好且成本低。该电池的总反应为2Zn+O2===2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为_______。
若以该电池为电源,用惰性电极电解硫酸铜溶液,为保证阴极有6.4g铜析出,理论上至少需要标准状况下 L空气(空气中含氧气按20%计算)进入该电池。