下列离子方程式正确的是( )
| A.钾跟水的反应:2K++ 2H2O = 2K+ + 2OH- + H2↑ |
| B.碳酸氢钠溶液和苛性钠溶液反应:H+ + OH- = H2O |
| C.过氧化钠加水:Na2O2 + H2O = 2Na+ + 2OH- + O2↑ |
| D.小苏打和少量澄清石灰水混合:Ca2+ + OH- + HCO3- = CaCO3↓+ H2O |
水热法制备Fe3O4纳米颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe3O4+S4O62-+2H2O,下列说法中不正确的是
| A.每生成1mol Fe3O4,反应转移的电子总数为4mol |
| B.Fe2+和S2O32-都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.x=4D |
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶 液中阳离子的判断正确的是
液中阳离子的判断正确的是
| A.只有Fe2+和Cu2+ | B.一定有Fe2+、Cu2+,可能有Fe3+ |
| C.一定有Fe2+,可能有Cu2+ | D.只有Fe2+ |
在给定条件下,下列加点的物质在化学反应中完全消耗的是
| A.用50mL 12mol/L的氯化氢水溶液与足量二氧化锰共热制取氯气 |
| B.向100mL 3mol/L的硝酸中加入5.6g铁 |
| C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中 |
| D.在5×107Pa、500℃和铁触媒催化的条件下,1mol氮气和3mol氢气反应 |
“类推”的思维方式在化学学习与研究中经常采用,但是有时会产生错误结论。下列类推结论中,正确的是
| A.Fe2O3和硝酸反应生成Fe(NO3)3和水,所以FeO和硝酸反应生成Fe(NO3)2和水 |
B.由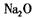 中阳离子与阴离子的个数比为2:1,可推出 中阳离子与阴离子的个数比为2:1,可推出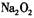 中阳离子与阴离子的个数比为2:1 中阳离子与阴离子的个数比为2:1 |
C.由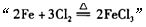 反应可推出 反应可推出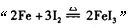 反应也能发生 反应也能发生 |
| D.FeBr2与少量Cl2反应的离子方程式为Fe2+ + Cl2 ="=" Fe3+ +2Cl-,可推出FeI2与少量Cl2反应的离子方程式也为Fe2+ + Cl2 ="=" Fe3+ +2Cl-。 |
有五个系列同族元素的物质,101.3 kP时测定它们的沸点(℃)如下表所示:
| ① |
He-268.8 |
(a)-249.5 |
Ar-185.8 |
Kr-151.7 |
| ② |
F2-187.0 |
Cl2-33.6 |
(b) 58.7 |
I2 184.0 |
| ③ |
(c) 19.4 |
HCl -84.0 |
HBr-67.0 |
HI-35.3 |
| ④ |
H2O 100.0 |
H2S-60.2 |
(d)-42.0 |
H2Te-1.8 |
| ⑤ |
CH4-161.0 |
SiH4-112.0 |
GeH4-90.0 |
(e)-52.0 |
对应表中内容,下列各项中不正确的是
A.a、b、c的化学式分别为Ne、Br2、HF
B.上表内物质HF和H2O,由于氢键的影响,其沸点比同族相应的氢化物要高。
C.系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D.系列②物质均有氧化性;系列③物质对应水溶液均是强酸