常见有机反应类型有:①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤加聚反应 ⑥缩聚反应 ⑦氧化反应 ⑧还原反应,其中可能在有机分子中新产生羟基的反应类型是( )
| A.①②③④ | B.⑤⑥⑦⑧ | C.①②⑥⑧ | D.③④⑤⑥ |
已知:CO2(g) + 3H2(g) 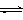 CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是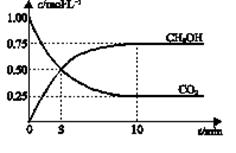
A.10min后,升高温度能使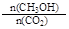 增大 增大 |
| B.反应达到平衡状态时,CO2的平衡转化率为75% |
| C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol·L-1•min-1 |
【改编】某有机物的结构如图所示,下列选项中均不正确的是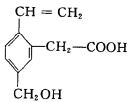
①属于烃;②能跟Na2CO3溶液反应;③分子式为C11H10O2;④能发生酯化反应;
⑤能发生加聚反应;⑥能发生水解反应;⑦含有3种官能团
| A.①③⑥ | B.②⑤⑥ |
| C.③⑥⑦ | D.④⑥⑦ |
下述实验操作没有错误的是
下列物质的转化在给定条件下能实现的是
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是
| A.原子半径由小到大的顺序:X< Y < Z< W |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1 |