镍氢电池的总反应式是 H2+2NiO(OH)  2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
A.NiO(OH) B.Ni(OH) 2 C.H2 D.H2和NiO(OH)
在2A+B 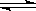 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)= 0.5 mol/(L·s)B.v(B)= 0.3 mol/(L·s)
C.v(C)= 0.8 mol/(L·s) D.v(D)= 1 mol/(L·s)
为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是
| A.稀释 | B.加稀硫酸 | C.加NaOH溶液 | D.加热 |
下列物质的水溶液中,除了水分子外,不存在其他分子的是
| A.HCl | B.NH4NO3 | C.Na2S | D.HClO |
在一定条件下,发生CO(g)+NO2(g) CO2(g)+NO(g)ΔH<0的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
CO2(g)+NO(g)ΔH<0的反应,达到平衡后,保持体积不变,降低温度,混合气体的颜色
| A.变深 | B.变浅 | C.不变 | D.无法判断 |
下列过程中,需要吸收能量的是
| A.H+H=H2 | B.H+Cl=HCl | C.I2→I+I | D.S+O2=SO2 |