A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是 ( )
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
下列实验能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
室温下,用pH试纸分别测定浓度为0.1 mol·L-1 NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
| B |
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 |
证明Na2CO3溶液中存在水解平衡 |
| C |
向10 mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀 |
证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D |
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
证明非金属性S>C |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是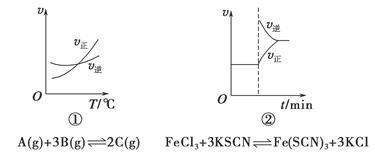
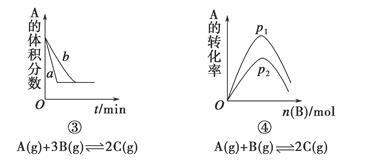
| A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0 |
| B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像 |
| C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线 |
| D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2 |
某温度下,对于反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是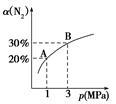
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
常温下,下列各组离子一定能在指定溶液中大量共存的是
| A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
B.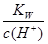 =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3- =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3- |
| C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- |
| D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32- |
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |