粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。为了除去杂质在实验室中可将粗盐溶于水然后进行下列操作:(1)过滤;(2)加入过量的氢氧化钠溶液;(3)加入适量的盐酸;(4)加过量Na2CO3溶液;(5)加过量的BaCl2溶液,以上操作的正确顺序是
| A.(5)(4)(2)(1)(3) | B.(1)(2)(3)(4)(5) |
| C.(5)(4)(3)(2)(1) | D.(1)(5)(4)(2)(3) |
100 mL 0.03 mol·L-1 Na2SO4溶液和50 mL 0.02 mol·L-1 Al2(SO4)3溶液混合,下列说法中正确的是(不考虑混合后溶液体积的变化)
| A.混合液中c(SO42-)为0.04 mol·L-1 |
| B.原Al2(SO4)3溶液中c(Al3+)与100 mL 0.02 mol·L-1 Al(NO3)3中c(Al3+)相等 |
| C.混合后的溶液中含有0.003 mol Na+ |
| D.混合后溶液中c(Na+)为0.02 mol·L-1 |
设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是
| A.0.2 mol/L的Ba(NO3)2溶液1L,含NO3-数为0.2NA |
| B.常温常压下,22.4L氧气所含的原子数为2NA |
| C.常温常压下,48gO2、O3组成的混合气体所含的氧原子数为3NA |
| D.1L 0.1mol/LNaCl溶液中所含的Na+的电子数为1.1NA |
下列从混合物中分离出其中的某一成分,所采取的分离方法正确的是
| A.利用氯化钾与碳酸钙的溶解性差异,可用溶解、过滤的方法除去碳酸钙 |
| B.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
| C.水的沸点是100 ℃,酒精的沸点是78.5 ℃,所以可用加热蒸馏法使含水酒精变为无水酒精 |
| D.氯化钠的溶解度随温度的下降而减小,所以可用冷却法从热的含有少量氯化钾的氯化钠浓溶液中得到纯净的氯化钠晶体 |
下列仪器常用于物质分离的是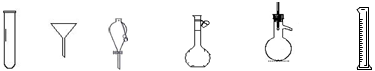
①②③④⑤⑥
| A.①③⑤ | B.①②⑥ | C.②④⑤ | D.②③⑤ |