下列依据热化学方程式得出的结论正确的是
| A.若2H2(g)+O2(g) ==2H2O(g) ΔH=—483.6 kJ·mol-1,则H2燃烧热为241.8 kJ·mol-1 |
| B.若C(石墨,s) ===C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=—57.4 kJ·mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D.已知2C(s)+2O2(g) ===2CO2(g) ΔH1;2C(s)+O2(g) ="2CO(g)" ΔH2,则ΔH1>ΔH2 |
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸②用酒精洗涤粘有硫粉的试管 ③用托盘天平称量10.1g氯化钠晶体④实验中不慎将手指划破,可立即用FeCl3溶液止血⑤用瓷坩埚熔融NaOH⑥用饱和NaHCO3溶液除去CO2中的少量SO2
| A.①②③④ | B.③④⑥ | C.③④⑤ | D.③⑤⑥ |
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示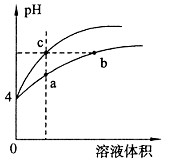
下列判断正确的是
| A.a、c两点溶液的导电能力相同 |
| B.b点溶液中c(H+)+c(NH3·H2O)===c(OH-) |
| C.a、b、c三点溶液中水的电离程度a>b>c |
| D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=Vc |
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 |
NaF |
NaClO |
Na2CO3 |
| pH |
7.5 |
9.7 |
11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)=" 0.1" mol·L-1
C.根据上表,水解方程式ClOˉ+ H2O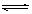 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2 C(g)△H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。
2 C(g)△H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图所示。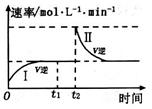
下列说法正确的是
| A.0~ t2时,v正>v逆 |
| B.I、Ⅱ两过程达到平衡时,A的体积分数I>II |
| C.t2时刻改变的条件是向密闭容器中加C |
| D.I、II两过程达到平衡时,平衡常数I<II |