某化学兴趣小组欲探究反应物浓度对化学反应速率的影响,在保持其他条件都相同的情况下,使四份质量分数不同的H2O2溶液发生分解反应:2H2O2=O2↑+2H2O,其中氧气生成速率最大的是
| A.5%H2O2溶液 | B.10%H2O2溶液 | C.20%H2O2溶液 | D.30%H2O2溶液 |
欲将溶液中的Al3+沉淀完全,最合适的试剂是
| A.NaOH溶液 | B.氨水 | C.Na2SO4溶液 | D.NaCl溶液 |
同分异构现象是造成有机物种类繁多的重要原因之一。下列各组物质中互为同分异构体的是
| A.13C与14C |
| B.CH3CH2OH与CH3COOH |
| C.甲烷与丙烷 |
D.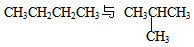 |
下列反应中,水作为还原剂的是
| A.Na2O + H2O===2NaOH | B.2F2+ 2H2O===4HF + O2 |
| C.Cl2 + H2O===HCl + HClO | D.3Fe + 4H2O Fe3O4 + 4H2 Fe3O4 + 4H2 |
能区别甲烷和乙烯两种气体的化学试剂是
| A.NaOH 溶液 | B.HCl | C.乙醇 | D.酸性高锰酸钾溶液 |
NaCl晶体中存在的化学键为
| A.离子键 | B.极性键 | C.共价键 | D.非极性键 |