酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业,乙酸乙酯的实验室和工业制法常采用如下反应: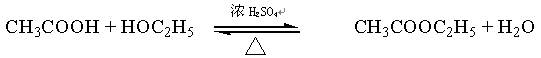
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 , 。(任写两点只要合理即可)
(2)浓硫酸的作用是:① 、② 。
(3)饱和NaCO3溶液的作用:
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率/% |
选择性/% |
反应时间/h |
转化率/% |
选择性/% |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.8 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
| 选择性100%表示反应无副反应发生 |
根据表中数据,下列 (填字母)为该反应的最佳条件。
| A.120 ℃,4 h | B.80 ℃,2 h | C.60 ℃,4 h | D.40 ℃,3 h |
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题: 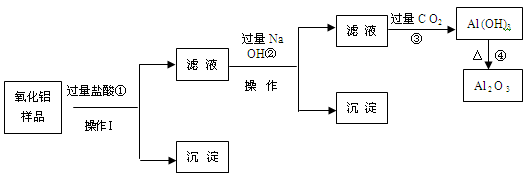
(1)沉淀A的成分是(填化学式),沉淀B的成分是(填化学式);
(2)滤液A中若加入过量的铁粉,可能发生的所有离子方程式为:
、 ;
(3)在操作Ⅰ的名称是,其中玻璃棒的作用是。
(共6分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)该反应的氧化剂是,2molN2参加反应转移电子数为。
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。
图中t4时引起平衡移动的条件可能是;图中表示平衡混合物中CO的含量最高的一段时间是。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是
(提示:272 = 729)
(共8分)过氧化氢水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液移至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- +H2O2+H+="=" Mn2++H2O+( )
(3)移取10mL过氧化氢溶液可以用_______(填“酸式”或“碱式”)滴定管。滴定到达终点的现象是____。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果______(填“偏高”或“偏低”或“不变”)。
(共4分)合成尿素的反应是分作两步进行的:
①2CO2(g)+ NH3(g) H2NCOONH4(aq)(氨基甲酸铵)△H =-159.47kJ/mol
H2NCOONH4(aq)(氨基甲酸铵)△H =-159.47kJ/mol
②H2NCOONH4(aq) CO(NH2)2(aq)+ H2O(l)△H =-28.49kJ/mol
CO(NH2)2(aq)+ H2O(l)△H =-28.49kJ/mol
在生产条件下,单位时间内获得尿素的产量与压强和n(NH3):n(CO2)的关系如图所示。
生产过程中n(NH3):n(CO2)的最佳配比为,而实际实际生产条件下,往往使n(NH3):n(CO2)≥3,这是因为。在得到的尿素溶液中会含有少量的氨基甲酸铵,除去这种杂质最简便的方法是。
(共8分)A、B、C、D、E均为可溶于水的固体,组成他们的离子有
| 阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
| 阴离子 |
OH- Cl- CO32- SO42- HSO4- |
分别取它们的水溶液进行实验,结果如下:①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)据此推断它们是(写化学式)A;B;C;D;E。
(2)写出④中反应的离子方程式:。
(3)A溶液中各种离子浓度由大到小的顺序为。