Ⅰ.下图是实验室制备乙酸乙酯的装置图,填写下列空白。
(1)试管A中加入沸石的作用是:__________。导管B的作用是导气和___________。
(2)试管C中的饱和碳酸钠溶液作用是:溶解乙醇、中和乙酸、____________。装置中通蒸汽的导管要插在溶液的液面以上,不能插在溶液中,目的是:________________。
(3)要将乙酸乙酯从试管C的混合物中分离出来,必须用到的仪器是_________。
Ⅱ.下图是实验室石油分馏的装置图,填写下列空白。
(4)A仪器的名称是____________,B仪器的名称是____________,B仪器内的水流方向是_______________(选答“上进下出”或“下进上出”)。
某化学兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题: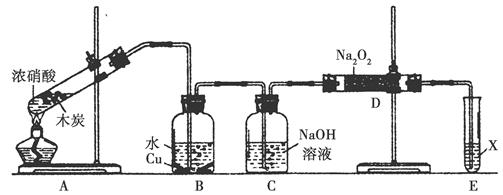
(1)组装好仪器后,必须进行的一项操作是_________________。
(2)装置A的试管中发生反应的化学方程式是_______________。
(3)推测B中可以观察到的主要现象是________;C装置的作用是________。
(4)装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是________;可以通过适当改进,不产生Y物质,请你提出改进方法:______________________。
(5)已知:亚硝酸是弱酸,不稳定,室温下存在反应3HNO2=HNO3+2NO↑+H2O;在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
①写出检验D中产物是亚硝酸钠的方法:_________________;
②E装置中试剂X可以是________。
| A.稀硫酸 | B.酸性高锰酸钾溶液 |
| C.稀硝酸 | D.水 |
图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。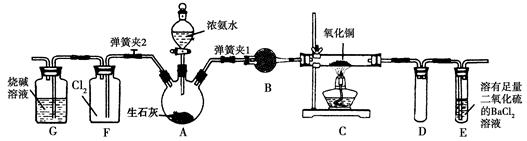
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先________,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是_________
__________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。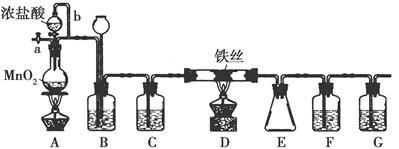
(1)装置A中反应的离子方程式为______________________。
(2)装置F中所加的试剂为________。
(3)导管b的作用为________;装置B的作用为___________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为____________________________________。
(5)反应结束后,拆卸装置前,必须进行的操作是__________。
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________(填序号)。
①Fe粉②KSCN溶液③酸性KMnO4溶液④NaOH溶液
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。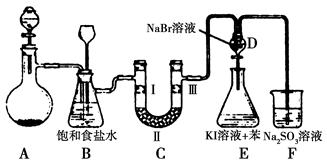
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为________。
(2)装置B中饱和食盐水的作用是________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:__________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
| 编号 |
a |
b |
c |
d |
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________该现象________(填“能”或“不能”)说明溴的非金属性强于碘,原因是__________________________。
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:__________________。请判断改用NaHSO3溶液是否可行?________(填“是”或“否”)。
为探究铜与稀硝酸反应产生的气体主要是NO,某课外活动小组设计了下列实验。图中D为止水夹,F是装有一半空气的注射器,其中加热装置和固定装置均已略去。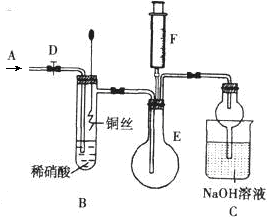
请回答有关问题:
(1)组装好装置后,关闭D,若装置的气密性良好,向外抽注射器活塞,C装置中有什么现象?
;
(2)反应开始前要向体系中通入气体A,为什么?;A可以是(填序号)①N2②O2③空气④CO2
(3)当完成装置A的实验目的后,关闭D,再将装置B中的铜丝插入稀硝酸。B中反应的离子方程式是:。
(4)反应一段时间后,将F中空气推入E中,证明生成了NO实验现象是:。
(5)装置C的作用是:。