下列物质中微粒的个数比不是1 : 1的是
| A.NaHCO3晶体中的阴离子和阳离子 | B.Na2O2固体中的阴离子和阳离子 |
| C.重氢原子中的质子和中子 | D.NH3分子中的质子和电子 |
金属钛(Ti)性能优越,被称为继铁、铝后的“第三金属”。工业上以金红石(TiO2)为原料制取Ti的反应为:
|
|
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)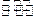 2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是()
2AB2(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),据此可得出的判断结论不正确的是()
A.达到平衡时A2的转化率大小为:b>a
B.a、b、c三点的平衡常数相同
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之
比一定是1:1
向1.00 L 0.3mol·L-1NaOH溶液中缓慢通入CO2气体至溶液增重8.8g。有关该溶液说法正确的是()
| A.溶质为Na2CO3 |
B. |
C. |
D. |
据《华盛顿邮报》报道,美国食品与药物管理局2009年10月公布了一份草拟的评估报告,指出塑料奶瓶和婴儿奶粉罐普遍存在的化学物质双酚A(如下图),并不会对婴儿或成人的健康构成威胁。关于双酚A的下列说法正确的是()
| A.该化合物属于芳香烃 |
| B.该化合物与三氯化铁溶液反应显紫色 |
| C.双酚A不能使溴水褪色,但能使酸性的高锰酸钾溶液褪色 |
| D.1mol双酚A最多可与4mol Br2发生加成反应 |
某混合溶液中所含离子的浓度如下表,则Mn+离子及a值可能为()
| 所含离子 |
NO-3 |
SO2-4 |
H+ |
Na+ |
Mn+ |
| 浓度(mol·L-1) |
3 |
1 |
2 |
1 |
a |
| A.Mg2+、1 | B.Ba2+、0.5 | C.Al3+、1.5 | D.Fe2+、2 |