致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、NH3、CH3Cl等作致冷剂,但它们不是有毒就是易燃烧。于是科学家根据元素性质的递变规律来开发新的致冷剂。据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期:______>______>H2O>HF;第三周期:SiH4> PH3 >H2S>HCl。
(2)化合物的毒性:PH3>NH3; H2S_____H2O; CS2_____CO2; CCl4>CF4于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.8°C, CF4的沸点为-128°C,新的致冷剂的沸点范围应介于其间。经过较长时间反复试验,一种新的致冷剂氟里昂CF2Cl2终于诞生了,其他类似的还可以是________________。已知甲烷是正四面体结构,则CF2Cl2_____(填有或者无)同分异构体。
(4)然而,这种致冷剂造成了当今某一环境问题是破坏臭氧层,但求助于周期表中元素及化合物的__________________(填写序号)变化趋势来开发致冷剂的科学学维方法是值得借鉴的。①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
茉莉花香气的成份有多种,乙酸苯甲酯( )是其中的一种,它可以从茉莉花中提取。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取。一种合成路线如下: 
回答下列问题:
(1)A物质的官能团是,C的结构简式为。
(2)反应③的反应类型为。
(3)写出反应①的化学方程式:。
(4)①②③反应中哪个反应的原子理论利用率为100%,符合绿色化学的要求。
(填序号)
N2在化工生产、农业、医疗、航天航空等领域用途广泛。现提供以下装置(连接仪器略去):
(1)某化学兴趣小组甲同学欲用加热NaNO2和NH4Cl的浓溶液制得N2,应该选择的发生装置是,在添加药品、制取气体前必须进行的操作是。
(2)在加热条件下,用NH3还原CuO可制得N2,同时获得铜粉,此反应的化学反应方程式是。
(3)乙同学利用②中反应原理制备干燥、纯净的N2,且需要的NH3以生石灰和浓氨水作原料。按气流从左到右的连接顺序是D→E→B→C,其中装置D中仪器X的名称是。装置C中试剂的作用是。
水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)在水煤气燃料电池中,通CO、H2的极为电池的极(选填“正”、“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g)△H<0,下列措施能提高反应速率的有(不定项选择)。
CO2(g) + H2(g)△H<0,下列措施能提高反应速率的有(不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为。
(4)将标准状况下582.4L合成气[已知:n(CO)∶n(H2)= 4∶9]通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),逸出的气体中乙烯的物质的量为。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:C;E 。
(2)化合物A2D2的电子式为。
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是。
(4)B的最高价氧化物的结构式。
(5)A和C形成的化合物与D单质的反应是重要的工业反应,写出反应方程式。
以石油裂解产物丙烯为原料合成一些新物质的路线如下。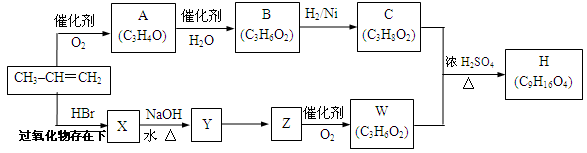
其中A、B、C、X、Y、Z、W、H均为链状化合物,A、Z均能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A中所含官能团的名称为,B的结构简式为。
(2)填反应类型:A→B,C+W→H。
(3)写出X→Y反应的化学方程式为:
。
(4)写出A与银氨溶液反应的化学方程式为:
。
(5)写出C+W→H的化学方程式为:
。
(6)符合下列条件分子式为C4H10O2的同分异构体有种,并写出其中核磁共振氢谱有3个吸收峰且吸收峰面积比为2∶2∶1的结构简式。
①与C互为同系物,②若分子中有两个羟基不能连在同一个碳原子上。