现有6种短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| W |
周期表中原子半径最小的元素 |
| U |
地壳中含量最多的金属元素 |
| R |
单质为空气的主要成分 |
| T |
M层上有6个电子 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有 个电子;元素X的一种核素可测定文物年代,这种核素的
符号是 。
(2)用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应 _____;
②元素U的单质与NaOH溶液反应_______________________________________。
(4)元素Z与元素T相比,非金属性较强的是 ,下列表述中能证明这一事实的
是 (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价
氧化物的水化物中,化学性质明显不同于其他三种的是 (用分子式表示),
理由是 。
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:NaBiO3+MnSO4+H2S04→Na2S04+Bi2(SO4)3+ NaMnO4+H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是。
③用单线桥表示该氧化还原反应。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式:。
实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是(填字号),配制上述溶液还需用到的玻璃仪器是(填仪器名称)。
(2)下列操作中,是容量瓶所具备的功能有。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度(填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作:。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是。
(5)下列操作会使配制的NaOH溶液浓度偏低的是。
A.用滤纸称量NaOHB.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是。
(2)NO2和N2O4的混合气体中,NO2的体积分数是。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是mL。
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝。上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(2)阳极氧化能使金属表面生成致密的氧化膜,装置如下图所示。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。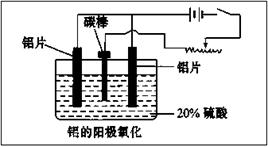
(3)下列说法正确的是。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
(1)肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量(25℃时),表示N2H4燃烧热的热化学方程式是____________________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:正极的电极反应式:__________________;负极的电极反应式:_______________。
(3)下图是一个电解过程示意图。
①锌片上发生的电极反应式是:_____________________________。
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。