人类对某金属冶炼技术的掌握程度决定了其应用的广泛性。影响冶炼方法的主要因素是
| A.金属的活动性大小 | B.金属在地壳中的含量多少 |
| C.金属的化合价高低 | D.金属的导电性强弱 |
钢铁发生腐蚀时,正极上发生的反应是
| A.2Fe-4e— =2Fe2+ | B.2Fe2++4e— ="2Fe" | C.2H2O+O2+4e—=4OH— | D.Fe3++e—=Fe2+ |
向下列溶液滴加稀硫酸,生成白色沉淀,继续滴加稀硫酸,沉淀又溶解的是
| A.Na2SiO3 | B.BaCl2 | C.FeCl3 | D.NaAlO2 |
用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 | B.白醋的导电性比盐酸的弱 |
| C.蛋壳浸泡在白醋中有气体放出 | D.pH试纸显示醋酸的pH为2~3 |
下列不能通过化合反应制得物质的是
| A.FeS | B.Al(OH)3 | C.Fe(NO3 )2 | D.Fe(OH)3 |
下列金属冶炼的反应原理,错误的是
A.2NaCl(熔融) 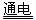 2Na+Cl2↑ 2Na+Cl2↑ |
B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe3O4+4CO  3Fe+4CO2 3Fe+4CO2 |
D.2HgO  2Hg+O2↑ 2Hg+O2↑ |