N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程中正确的是
| A.1/2 N2H4(g)+ 1/2 O2(g)= 1/2 N2(g)+ H2O(l)△H=+257kJ·mol-1 |
| B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-133.5kJ·mol-1 |
| C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJ·mol-1 |
| D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ·mol-1 |
美国每日科学网站文章报道:美国梅奥诊所的研究人员发现绿茶含有有助于消灭血癌细胞的成分—“表没食子儿茶素没食子酸酯”(EGCG)。研究显示,该成分通过干扰血癌细胞生存所需的信号传递,能使血癌(白血病)中癌细胞自杀性死亡。已知EGCG的结构简式如图,有关EGCG的说法不正确的是
| A.EGCG分子中含有两个手性碳原子 |
| B.EGCG遇FeCl3溶液能发生显色反应 |
| C.EGCG在空气中不易被氧化 |
| D.EGCG可与氢氧化钠溶液反应 |
现有甲酸、乙醛、丙酸甲酯、2-甲基-1-戊烯组成的混合物中,测得其中氧的质量分数为15.3%,则氢的质量分数为
| A.84.7 % | B.72.6 % | C.12.1 % | D.6.05 % |
有关下图所示化合物的说法不正确的是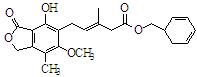
| A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 |
| B.1 mol该化合物最多可以与3mol NaOH反应 |
| C.既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式: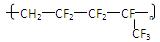 ;合成它的单体是()
;合成它的单体是()
| A.氟乙烯和全氟异丙烯; | B.1,1-二氟乙烯和全氟丙烯 |
| C.1-三氟甲基础-1,3-丁二烯 | D.全氟异戊二烯 |
下列离子方程式正确的是
A.某有机酸与碳酸氢钠反应: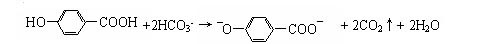 [来 [来 |
| B.醋酸溶液与新制氢氧化铜反应:2 H++Cu(OH)2→Cu2++2H2O |
| C.苯酚钠溶液中通入少量二氧化碳:C6H5O—+ CO2 + H2O→C6H5OH+HCO3— |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+2[Ag(NH3)2]++2OH- CO32-+2NH4+ + 2Ag↓+ 2NH3+ H2O
CO32-+2NH4+ + 2Ag↓+ 2NH3+ H2O