下列物质的分类合理的是
下图装置可用于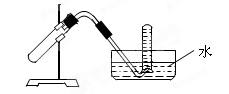
| A.加热NaHCO3固体制CO2 |
| B.Cu和稀HNO3反应制NO |
| C.NH4Cl与浓Ca(OH)2溶液反应制NH3 |
| D.Cu和浓HNO3反应制NO2 |
下列关于NaHCO3和Na2CO3的叙述不正确的是
| A.NaHCO3比Na2CO3稳定 |
| B.NaHCO3、Na2CO3可相互转化 |
| C.NaHCO3可用于焙制糕点;Na2CO3可用于玻璃、造纸等工业 |
| D.都能与澄清石灰水反应生成白色沉淀 |
设 NA为阿伏加德罗常数的数值,下列说法正确的是
| A.NA个CH4分子的质量为16g/mol |
| B.1mol/LNaCl溶液含有NA个Na+ |
| C.等物质的量的N2和CO所含分子数、原子个数、电子总数均相同 |
| D.22.4LCO2中含有 NA个CO2分子 |
下列说法错误的是
| A.溶液、胶体和浊液这三种分散系的根本区别是分散质粒子的大小 |
| B.NO可用排空气法进行收集 |
| C.不可用浓硫酸干燥氨气 |
| D.SO2的大量排放会引起酸雨 |