某微粒用 表示,下列关于该微粒的叙述正确的是( )
表示,下列关于该微粒的叙述正确的是( )
| A.所含质子数="A-n" | B.所含中子数=A-Z |
| C.所含电子数="Z+n" | D.质量数=Z+A |
已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W与Z、X和Y分别同主族,Y、Z同周期。Z能与X形成两种常见的离子化合物,阴、阳离子个数比均为1:2。下列说法错误的是
| A.Y、Z、X、W的原子序数依次减小 |
| B.X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C.由W、X、Y、Z四种元素组成的常见化合物可能显强酸性 |
| D.W与X可形成既含极性共价键又含非极性共价键的化合物 |
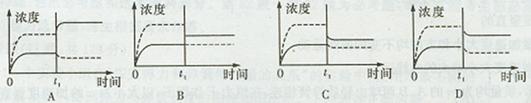
已知常温下Ca(OH)2的KSP为5.6×10-6,在常温下将适量Ca(OH)2固体溶于100mL水中至刚好饱和,该过程中Ca2+和OH-浓度随时间变化关系如右图[饱和Ca(OH)2溶液中c(Ca2+)=1.118×10-2 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1 CaCl2溶液,下列示意图中,能正确表示t1时刻后Ca2+和OH-浓度随时间变化关系的是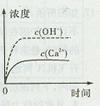
以H2O2、熔融盐Na2CO3组成的燃料电池来电解制备N2O5,装置如下图所示,其中Y为CO2。下列说法错误的是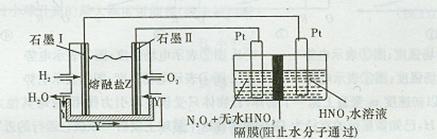
| A.石墨Ⅱ电极上发生反应的电极反应式为:O2+4e一十2CO2=2CO32- |
| B.在电解池中生成N2O5的电极反应式为:N2O4+2NO3一-2e一=2N2O5 |
| C.放电时熔融盐中CO32-向石墨I电极方向移动 |
| D.每消耗11.2 L(标准状况)氢气,理论上可以制得108 g N2O5 |
向20 mL 0.5 mol/L的氨水中逐滴加入等物质的量浓度的盐酸,测定溶液的温度变化如图所示。下列关于混合溶液的说法错误的是
| A.从a点到b点,混合溶液不可能存在:c(Cl-)=c(NH4+) |
| B.由水电离的c(H+):b点>c点 |
| C.氨水的电离平衡常数:b点>a点 |
| D.b焦到c点,混合溶液中可能存在:c(Cl一)>c(H十) >c(NH4+)>c(OH-) |
解释下列事实的方程式不正确的是
| A.次氯酸钙溶液中通人过量二氧化碳:ClO- +H2O+CO2=HCO3-+HClO |
| B.硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3十O2=2H2SO4 |
| C.已知:Fe2O3(s)+3C(s,石墨) =2Fe(s)+3CO(g)△H=十489.0kJ/mol CO(g)+  O2(g)=CO2(g)△H=-283.0 kJ/mol O2(g)=CO2(g)△H=-283.0 kJ/molC(s,石墨)+O2( g)=CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)=2Fe2O3(s)△H=-1641.0kJ/mol |
| D.在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是: |
3NH4+十Fe3++3SO42- +3Ba2++6OH- =3BaSO4↓+Fe(OH)3↓+3NH3·H2O