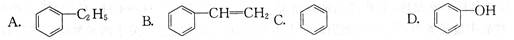将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为: ( )
| A.40mL 水 | B.10mL 0.2 mol·L-1Na2CO3溶液 |
| C.50mL 0.01 mol·L-1氯化钡溶液 | D.100mL 0.01 mol·L-1盐酸 |
下列对有机物结构或性质的描述,错误的是
| A.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B.光照下2,2—二甲基丙烷与Br2反应其一溴取代物只有一种 |
| C.甲苯与浓硫酸、浓硝酸的混合酸在30℃时主要生成邻硝基甲苯和对硝基甲苯 |
| D.苯酚钠溶液中通入少量CO2生成苯酚,同时生成碳酸钠 |
某烃1 mol最多能和2 mol HCl加成,生成氯代烃,此氯代烃l mol能和6 mol Cl2发生取代反应,生成物中只有碳氯两种元素,此烃为
| A.C2H2 | B.C2H4 | C.C3H4 | D.C6H6 |
尼泊金甲酯可在化妆品中作防腐剂。结构简式为 ,下列说法中不正确的是
,下列说法中不正确的是
| A.该物质属于芳香烃 |
| B.该物质的分子式为C8H8O3 |
| C.该物质能够和FeCl3反应,使溶液呈紫色 |
| D.在一定条件下,1mol该物质最多能和2molNaOH反应 |
下列各组混合物中,都能用分液漏斗分离的是()
| A.乙酸乙酯和水酒精和水苯酚和水 |
| B.二溴乙烷和水溴苯和水硝基苯和水 |
| C.甘油和水已烷和水甲酸和水 |
| D.苯和甲苯乙醛和水乙酸和乙醇 |
下列芳香族化合物常温下能与溴水发生取代反应的是()