有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
某物质由A、B、C三种元素组成,其晶体中微粒的排列方式如图所示:则该晶体的化学式是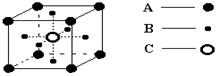
A. AB3C3 B. AB3C C.A2B3C D. A2B2C
某酸的酸式盐NaHY在水溶液中,HY—的电离程度小于HY—的水解程度,有关叙述正确的是
A.H2Y在电离时:H2Y+H2O HY—+H3O+ HY—+H3O+ |
| B.在该盐的溶液中,离子浓度为:c(Na+)>c(HY—)>c(Y2—)>c(OH—)>c(H+) |
| C.在该盐的溶液中,离子浓度为:c(Na+)>c(Y2—)>c(HY—)>c(OH—)>c(H+) |
D.HY—水解方程式为:HY—+H2O Y2—+H3O+ Y2—+H3O+ |
有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
| A.在三种酸HX、HY、HZ中以HX酸性相对最强 |
| B.HX、HY、HZ三者均为弱酸 |
| C.在X—、Y—、Z—三者中,以Z—最易发生水解 |
| D.中和1molHY酸,需要的NaOH稍小于1mol |
A、B的转化率随其物质的量之比的变化曲线如图所示,该反应可能是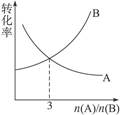
A. A+B C B. 3A+2B
C B. 3A+2B 2C
2C
C. 3A+B 2C D .A+3B
2C D .A+3B C
C
某固体化合物A不导电,但熔化或溶于水都能完全电离,下列关于A的说法中正确的是
| A.A为非电解质 | B.A是强电解质 | C.A是分子晶体 | D.A为弱电解质 |