工业纯碱中常常含有NaCl、Na2SO4等杂质。为测定某工业纯碱的纯度,设计了如下图实验装置。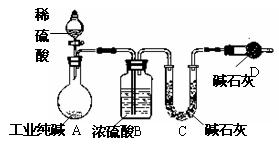
依据实验设计,请回答:
(1)装置中盛装稀硫酸的仪器名称是 ;
装置D的作用是
。
(2)为达到测定某工业纯碱的纯度实验目的,一次实验中至少应进行称量操作的次数为 。
(3)若不考虑操作、药品及其用量等方面
的影响,该实验测得结果会 (填“偏高”、“偏低”、“无影响”);
原因是
(你若认为无影响,该空不用回答)。
丁烷在一定条件下裂解可按两种方式进行:
C4H10 C2H6+C2H4, C4H10
C2H6+C2H4, C4H10  CH4+C3H6。
CH4+C3H6。
下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)
按上图连好装置后,需进行的实验操作有:①给D、 G装置加热;②检查整套装置的气密性;③排出装置中的空气等
⑴这三步操作的先后顺序依次是_________。
⑵氧化铝的作用是____,
写出甲烷与氧化铜反应的化学方程式;
⑶B装置所起的作用是__________________。
⑷若对E装置中的混合物(溴水足量),再按以下流程实验:
①操作I、操作II分别是、;
②已知D的氢核磁共振谱图上只有一种峰,则D的结构简式;
③Na2SO3溶液的作用是;
(5)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) =______(假定流经D、G装置中的气体能完全反应)
氯化铵是一种重要的化工原料,应用广泛。
(1)实验室通常用NH4Cl固体与Ca(OH)2固体混合共热制取氨气。
写出实验室制取氨气的反应方程式 。
(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是(填字母)。
①幕布的着火点升高②幕布的质量增加③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
| A.①② | B.③④ | C.①③ | D.②④ |
(3)实验室可用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应方程式为:
NaNO2+NH4Cl NaCl+N2↑+2H2O实验装置如图所示,试回答:
NaCl+N2↑+2H2O实验装置如图所示,试回答: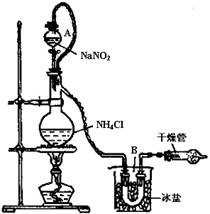
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是(填写编号)。
a.防止饱和溶液蒸发
b.保证实验装置不漏气
c.使饱和NaNO2溶液容易滴下
②加热前必须进行的一个操作步骤是 。
已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3  Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。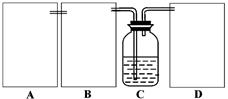
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下装置(填序号)。简述该装置能随关随停的理由。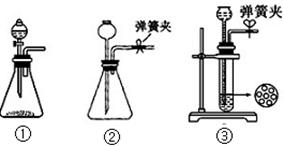
(2)为使实验能够进行,在B、D方框内补上所需装置:(将装置图画在答题卡上),并指明所用试剂:。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导 下,
下, 他们对
他们对 某个装置进行了改进,达到了实验目的。你认为他们的改进方法是。
某个装置进行了改进,达到了实验目的。你认为他们的改进方法是。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为。
配制250mL 4.0mol·L-1Na2CO3溶液的实验步骤:
a、计算需要碳酸钠固体的质量。
b、称量碳酸钠固体。
c、将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入250 mL容量瓶。
d、用适量蒸馏水溶解称量好的碳酸钠固体,冷却。
e、盖好瓶塞,反复上下颠倒,摇匀。
f、继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管加蒸馏水至凹液面最低液而与刻度线相切。
(1)所需称量的碳酸钠固体的质量是。
(2)上述步骤的正确操作顺序是。
(3)供选用的仪器有:①玻璃棒;②胶头滴管;③10mL量筒;④100mL容量瓶;⑤250mL容量瓶;⑥天平;⑦50mL烧杯;应选用的仪器(填编号)
。
.如图A、B两个装置,回答下列问题: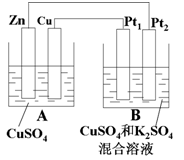
(1)A为_________池,Pt1为______极。
(2)当电路中通过0.02mol电子时,A溶液质量变化为_______________g。
(3)同时B中收集到标准状况下的气体224mL,则反应前B池中原混合溶液中Cu2+的浓度是________(设B中原混合液的体积为200mL)。