反应4A(g)+5B(g) 4C(g)+6D(g)在5L的密闭容器中进行反应,30 min后,C的物质的量增加了0.30 mol。下列叙述正确的是
4C(g)+6D(g)在5L的密闭容器中进行反应,30 min后,C的物质的量增加了0.30 mol。下列叙述正确的是
A.30 min 中A的平均反应速率是0.010 mol•L-1•s-1
B.容器中含D的物质的量为0.45 mol
C.容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D.容器中A的物质的量一定增加0.30 mol
下列说法错误的是
| A.化学反应的限度可以通过改变条件而改变 |
| B.可逆反应达到平衡状态时,就是此条件下该反应所能达到的限度 |
C.2mol 与1mol 与1mol 混合一定能生成2mol 混合一定能生成2mol  |
| D.不同可逆反应的反应限度不同 |
下列物质中,只含有离子键,不含有共价键的是
| A.HCl | B.CaCl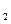 |
C.Na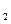 O O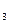 |
D.Cl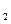 |
下列过程属于物理变化的是
| A.皂化反应 | B.石油裂化 | C.石油分镏 | D.煤的干馏 |
下列措施对增大化学反应速率无明显效果的是
A.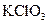 分解制氧气时,加入催化剂且加热 分解制氧气时,加入催化剂且加热 |
| B.做铝与稀盐酸反应的实验时,将铝片改为铝粉 |
| C.铁与稀硫酸反应制取氢气时,改用质量分数为98%的浓硫酸 |
| D.锌与稀硫酸反应时,加入少量铜粉 |
下列有关化学用语正确的是
A.乙烯的结构简式 |
B.乙烯的结构式 |
C.羟基官能团 |
D.乙酸的分子式 |