X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素符号为_▲___ ;M在元素周期表中的位置为_▲____;五种元素的原子半径从大到小的顺序是_▲____(用元素符号表示)。
(2)以上元素所构成的10个电子的微粒当中,某些微粒之间反应可以得到一种白色沉淀,请写出离子方程式 ▲ 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_▲_,其最高价氧化物对应的水化物化学式为__▲__。
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究.填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因I:Cl-对反应具有促进作用,而 对反应没有影响;
对反应没有影响;
原因II:_ __________________________________;
__________________________________;
原因III:Cl-对反应具有促进作用,而 对反应具有阻碍作用;
对反应具有阻碍作用;
原因IV:Cl-、 均对反应具有促进作用,但Cl-影响更大;
均对反应具有促进作用,但Cl-影响更大;
原因V:____________________________________________________
(2)该同学设计并进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和稀盐酸的试管(两试管的 规格相同)中:
规格相同)中:
①在盛有稀硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
②在盛有稀盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。若观察到实验1中_________,实验2中__________,则说明原因III是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(3)为了使实验“定量化”, 使结果更精确,可以对实验进行如下改进:
使结果更精确,可以对实验进行如下改进:
①配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用________(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为____________。
配制溶液时还需要用到的玻璃仪器有_____________、__________、烧杯、胶头滴管和量筒等。
②比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。
常温下有一PH为12的NaOH溶液100mL,如果将其PH将为11,那么
(1)若用蒸馏水应加入mL(2)若用PH=10的NaOH溶液应加入mL
(3)若用PH=2的盐酸应加入mL(4)若用0.01mol/L的硫酸溶液应加入mL
常温下已知pH=2的高碘酸(HIO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得溶液显中性。请回答下列问题:
(1)高碘酸是(填“强酸”或“弱酸”),理由是。
(2)0.01mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合所得溶液中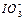 与Na+的浓度关系是(填“大于”“小于”或“等于”)。
与Na+的浓度关系是(填“大于”“小于”或“等于”)。
(3)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的还原剂是,该反应的离子方程式可表示为。
(14分)(1)Na2SO3溶液蒸干得到的固体物质是___________,原因是______________.
(2)碳酸氢钡溶液蒸干得到的固体物质是___________,原因是___________________.
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为_________,原因是_____________________________________________________。
(4)与c(H+)·c(OH-)=kw类似,FeS饱和溶液中存在:FeS(s) 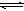 Fe
Fe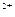
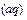 +S
+S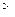
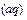 ,
,
c(Fe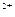 )·c(s
)·c(s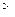 )=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
)=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
理论上FeS的溶解度为___________________。
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,则表示甲烷燃烧热的热化学方程式为。