某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是
| A.Na+、K+、Cl-、OH- | B.H+、Na+、SO42-、NO3- |
| C.K+、Ca2+、NO3-、SO32- | D.Na+、Mg2+、S2-、MnO4- |
设nA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,2.24L SO3含有的分子数为0.1nA |
| B.常温下,3.0g甲醛含有C-H键数目为0.2nA |
| C.含有2molH2SO4的浓硫酸与足量Cu加热条件充分反应,电子转移数是2nA |
| D.1L 1mol/L AlCl3溶液含Al3+数目为nA |
能正确表示下列反应的离子方程式的是
| A.NO2与水的反应:3NO2+H2O=2NO3-+NO+2H+ |
| B.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O |
| D.NH4HCO3溶于过量的NaOH溶液中:HCO3-+ OH-=CO32-+H2O |
下列实验方案能达到预期目的的是
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂
| A.①②④ | B.①②⑤ | C.②④⑤ | D.②③④ |
下列说法错误的是
| A.“接触法”制H2SO4过程中,选择98%的浓硫酸作为SO3的吸收剂 |
B.海水提镁的主要步骤为: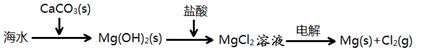 |
| C.侯德榜制碱法最终制得的是纯碱 |
D.高炉炼铁过程 中的还原剂主要是CO 中的还原剂主要是CO |
X、Y、Z是3种短周期元素,其中X、Z位于同一主族,X、Y处于同一周期。X原子的最外层电子数是其电子层数的3倍。X原子的核外电子数比Y原子少1。下列说法正确的是
| A.元素非金属性由弱到强的顺序为Z<Y<X |
| B.Y元素的氢化物是一种强酸 |
| C.3种元素的气态氢化物中,Y的气态氢化物还原性最强 |
D.其对应的阴离子半径由大到小的顺序为 |