下表是元素周期表的一部分。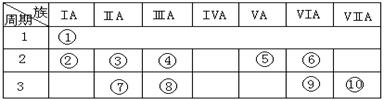
⑴下列说法正确且能说明元素⑩的非金属性比元素⑨强的是 。
| A.同温同压下,元素⑩的气态氢化物溶解度大于元素⑨的气态氢化物 |
| B.元素的最高价氧化物对应的水化物的酸性⑩强于⑨ |
| C.元素⑨和⑩的单质与铁反应分别得到低价、高价铁的化合物 |
| D.元素⑩的电负性大于元素⑨ |
⑵某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,与该元素单质分子互为等电子体的二价阴离子是 。
⑶已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与盐酸反应的离子方程式:
。
⑷上述元素⑦形成的晶体对应的晶胞为下图中的___________________(填写序号)。
甲 乙 丙 丁
⑸元素④的含氧酸的结构式可表示为 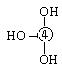 则可判断该酸为 酸(填强或弱)
则可判断该酸为 酸(填强或弱)
一分子该酸与水作用,只能产生1个H+,请写出该酸溶于水后溶液显酸性的离子方程式 。
⑹已知元素⑧气态氯化物的化学式为R2Cl6,结构式如下,试并标出其中的配位键 Cl Cl Cl
Cl Cl Cl
Al Al
Cl Cl Cl
已知气态氯化铝分子以双聚形式存在,其结构式如下图所示:
图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享,又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面这个方程式右端的两种离子的表达式: ______+______
______+______
在一定条件下可实现如图所示物质之间的相互转变:
(1)根据你的推测,请填写下列物质的化学式:
A:______;B:______,D:______;G:______,
(2)简要说明A可转变为B和C的原因,写出有关反应的化学方程式:
___________________________________________________
(3)写出E气体与A溶液反应的离子反应方程式:______
一种由电石为原料合成的烃,其化学式为C4H4,它是合成一种橡胶的中间体,它有多种同分异构体。
请回答:
(1)它的一种链式结构的同分异构体的结构简式是______。
(2)它的一种同分异构体,每个碳均达饱和,且构成的空间构型中碳与碳间的夹角都相同,该结构中碳与碳间的键角应是________。
A、B都是芳香族化合物,1molA水解得到1molB和1mol醋酸。A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O。且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652)。A溶液具有酸性,不能使FeCl3;溶液显色。
(1)A、B分子量之差为______。
(2)1个B分子中应该有_______个氧原子。
(3)A的分子式是________。
(4)B可能的三种结构简式是______、______、_______。
一卤代烃Rx与金属钠作用,可以增加碳链制高级烃,反应的化学方程式为Rx+2Na+R′x→R—R′+2Nax,其中x表示卤原子,R和R′为烃基,可相同也可不同,试以苯、乙炔、Br2、HBr销为主要原料,通过三步反应制取 CH=CH2,其制取的化学方程式为(1)_______,(2)______,(3)_______。
CH=CH2,其制取的化学方程式为(1)_______,(2)______,(3)_______。