下列叙述正确的是
| A.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 |
| B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” |
| C.废电池需回收,主要是要利用电池外壳的金属材料 |
| D.升高温度可降低活化能 |
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是
2SO3(g),能增大正反应速率的措施是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
已知:2Zn(s)+O2(g) 2ZnO(s)ΔH="-701.0" kJ·mol-1
2ZnO(s)ΔH="-701.0" kJ·mol-1
2Hg(l)+O2(g) 2HgO(s)ΔH="-181." 6 kJ·mol-1
2HgO(s)ΔH="-181." 6 kJ·mol-1
则反应Zn(s)+HgO(s)==ZnO(s)+Hg(l)的ΔH为
| A.+519.4 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol-1 |
下列说法中正确的是
| A.凡是放热反应都是自发的,凡是吸热反应都是非自发的 |
| B.自发反应一定是熵增大的反应,非自发反应一定是熵减小的反应 |
| C.自发反应在恰当条件下才能实现 |
| D.自发反应在任何条件下都能实现 |
下列热化学方程式或说法正确的是
| A.甲烷的燃烧热为ΔH=-890 kJ·mol-1 ,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890 kJ· mol-1 |
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=-38.6 kJ·mol-1 2NH3(g) ΔH=-38.6 kJ·mol-1 |
| C.已知:H2(g)+F2(g)="==2HF(g)" ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是
①C(s)+O2(g)===CO2(g) ΔH1; C(s)+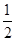 O2(g)="==CO(g)" ΔH2
O2(g)="==CO(g)" ΔH2
②S(s)+O2(g)===SO2(g) ΔH3; S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+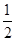 O2(g)===
O2(g)===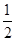 H2O(l)ΔH5; 2H2(g)+O2(g)===2H2O(l)ΔH6
H2O(l)ΔH5; 2H2(g)+O2(g)===2H2O(l)ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7;CaO(s)+H2O(l)===Ca(OH)2(s)ΔH8
| A.① | B.④ | C.②③④ | D.①②③ |