A+,B2+,C-离子都由1~18号中某些元素组成。A+离子中键角为109°28',B2+离子中没有化学键。C-离子中有9个质子,具直线型结构。已知A+,B2+,C-均有10个电子。试回答
(1)写出离子符号:A+______,B2+______,C-______。
(2)下列微粒:Ca2+,Ag+,质子,中子,哪些最易与C-结合为挥发性稳定化合物______
某高分子材料的结构为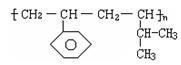 ,则其对应的单体的结构简式为:______________________,______________________。
,则其对应的单体的结构简式为:______________________,______________________。
组成一种原电池如图所示。试回答下列问题(灯泡功率合适):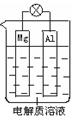
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”做①题,填
“不亮”做②题)。
①若灯泡亮,则Mg电极上发生的反应为:____________________;
Al电极上发生的反应为:___________________________________。
②若灯泡不亮,其理由为:__________________________________。
(2)电解质溶液为NaOH溶液时,灯泡_____(填“亮”做①题,填“不亮”做②题)。
①若灯泡亮,则Al电极上发生的反应为:_____________________________。
②若灯泡不亮,其理由为:__________________________________________。
(6分)某种解热镇痛药的结构简式如图所示: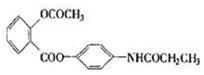
当它完全水解时可得到的产物有种;写出其中含有苯环的产物的结构简式:
(5分)现有CH4、C2H4、C2H2、C2H6、C3H8五种有机物,回答下列问题:
⑴.质量相同时,在相同状况下体积最大的是__ ____,完全燃烧时消耗O2的量最多的是__ __,生成的CO2最多的是___ _,生成水最多的是___ ___。
⑵.同温同体积时,五种物质完全燃烧耗O2的量最多的是__ ____。
(10分)分子中只含有2个碳原子的某烃A是其同系物中含碳量最高的物质; 1mol A与1mol HCl加成可得到B;1mol A与1mol H2加成可得到C,并能继续发生如下列图表所示的转变:</PGN0306.TXT/PGN>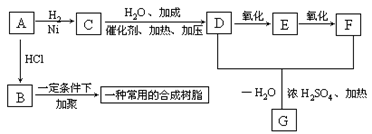
据此回答下列问题
(1) 写出实验室制取A的反应方程式 ___ _ ____________ ___ ____;
(2) 以B为原料经过加聚反应所得的合成树脂的结构简式为__ ___ _____。
(3) 写出由D和F生成G的反应方程式:
________________________ ________ __
(4) 写出E与银氨溶液反应的化学方程式:
___________ ____ ____ _________
(5) 写出符合以下两个条件的G的同分异构体,①能水解②能发生银镜反应: