在容积相同的甲、乙两个密闭容器中,均分别加入2molSO2和1mol O2,同时发生下列反应:2SO2(g)+O2(g 2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
2SO3(g),在相同温度下达到平衡。若甲容器保持体积不变,乙容器保持压强不变,测得甲容器中SO2的转化率为25%,则下列说法中正确的是
| A.反应过程中的某时刻,甲容器中的反应速率比乙中的大 |
| B.达到平衡时,甲容器反应所需时间比乙容器少 |
| C.乙容器中SO2的转化率大于25% |
| D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2 |
生活中碰到的某些问题常常涉及到化学知识,下列叙述正确的是
①人的皮肤在强紫外线的照射下将会失去生理活性
②为了防止海产食品腐烂变质,用甲醛溶液浸泡
③油脂变质会发出难闻的特殊气味,是由油脂的物理性质决定的
④蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水
⑤四氯化碳和苯是常见的有机溶剂,日常用于清洗衣服上的油污
| A.①④ | B.②③④ | C.①②④⑤ | D.全部 |
某链状有机物分子中含有n个-CH2-,m个-CH-,a个-CH3,其余为-OH,则羟基的个数为
| A.2n+3m-a | B.m+2-a | C.n+m+a | D.m+2n+2-a |
下列有机物命名正确的是
A. 2-乙基丙烷 2-乙基丙烷 |
B. CH3CH2CH2CH2OH 1-丁醇 |
C. 间二甲苯 间二甲苯 |
D. 2-甲基-2-丙烯 2-甲基-2-丙烯 |
第一次用无机物制备有机物尿素,开辟人工合成有机物先河的科学家是
| A.德国的维勒 | B.英国的道尔顿 |
| C.德国的李比希 | D.俄罗斯的门捷列夫 |
在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g) 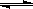 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.C、D的物质的量的比值 D.气体的总物质的量