乙醇分子中不同的化学键如图所示,乙醇各种反应中应断裂的键说明不正确的是( )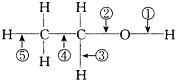
| A.和金属钠作用时,键①断裂 |
| B.和浓H2SO4共热至170℃时,键②和⑤断裂 |
| C.和CH3COOH共热时,键②断裂 |
| D.在Ag催化剂下和O2反应时,键①和③断裂 |
浓度为0.01mol·L—1的HCl溶液VmL,加水稀释到2VmL后取出10mL,这10mL溶液中c(H+)为()
| A.0.05mol/L | B.0.001mol/L |
| C.0.002mol/L | D.0.005mol/L |
下列四个化学反应中,符合此漫画情景的是()
A.H2+CuO Cu+H2O Cu+H2O |
B.CuO+CO Cu+CO2 Cu+CO2 |
| C.Fe+H2SO4=FeSO4+H2↑ | D.Fe+CuSO4=FeSO4+Cu |
为了除去粗盐中Ca2+、Mg2+、SO42—及泥沙,将粗盐溶于水然后进行下列操作:①过滤;②加过量的NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量的BaCl2溶液。正确操作的顺序是()
| A.①④⑤②③ | B.④①②⑤③ |
| C.②⑤④①③ | D.⑤②④③① |
下列物质容易导电的是()
| A.熔融状态下的氯化钾 | B.液态的氯化氢 |
| C.硫酸铜晶体 | D.无水乙醇 |
下列说法正确的是()
| A.摩尔是物质的量的单位 |
| B.熔融状态下或溶液中能导电的物质就是电解质 |
| C.氧化还原反应的本质是元素化合价发生了变化 |
| D.得电子的物质被还原,是还原剂 |