在一个固定体积的密闭容器中加入2mol A,发生可逆反应2A(g)  2B(g)+C(g)。该反应达到平衡的标志是( )
2B(g)+C(g)。该反应达到平衡的标志是( )
A.容器内压强是开始时的1.5倍
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC
D.容器内各物质的浓度不随时间变化
X、Y、Z、W是中学化学常见的四种物质,他们之间具有如图所示转化关系,则下列组合不可能的是 
| X |
Y |
Z |
W |
|
| A |
C |
CO |
CO2 |
O2 |
| B |
Na |
Na2O |
Na2O2 |
O2 |
| C |
AlCl3 |
Al(OH)3 |
NaAl(OH)4 |
NaOH |
| D |
Fe |
FeCl2 |
FeCl3 |
Cl2 |
有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol/L,c(Cl-)=1.3 mol/L,要使Mg2+全部转化为沉淀分离出来,至少需要4mol/L NaOH 溶液的体积是
| A.40mL | B.72 mL | C.80 mL | D.128mL |
Fe3+、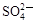 、Al3+ 和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,则X可能是
、Al3+ 和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,则X可能是
| A.Cl– | B.Na+ | C.OH– | D.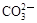 |
有3份等质量的小苏打,第1份直接与过量盐酸反应;第2份先加热,使其部分分解后,再与过量盐酸反应;第3份先加热,使其完全分解后,再与过量盐酸反应。假若盐酸的物质的量浓度相同,实际消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是
| A.V1>V2>V3 | B.V1>V3>V2 | C.V2>V3>V1 | D.V1=V2=V3 |
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
| A.2 mol | B.1 mol | C.0.5 mol | D.0.25 mol |