在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是 ( )
| A.3∶2 | B.2∶1 | C.1∶1 | D.2∶3 |
下列各组离于在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是
A Na+ Ba2+ Cl- SO42- B K+ AlO2- NO3-OH-
C H+NH+4 Al3+ SO42- D H+ Cl- CH3COO- NO3-
某溶液中含有大量Fe2+、Fe3+、Mg2+和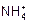 ,其c(H+)=10-2mol·L-1,在该溶液中可以大量存在的阴离子是
,其c(H+)=10-2mol·L-1,在该溶液中可以大量存在的阴离子是
A.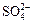 |
B. |
C.SCN- | D. |
下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺 序排列的一组是
序排列的一组是
| A.F2、K、HCl | B.Cl2、Al、H2 | C.NO2、Na、B r2 r2 |
D.O2、SO2、H2O |
下列化学用语表示正确的是
A.氯化钠的电子式为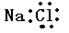 |
B.次氯酸的电子式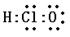 |
| C.二氧化碳的结构式为O=C=O |
D.NaHCO3的电离方程式为NaH CO3=Na++H++CO32- CO3=Na++H++CO32- |
具有相同电子层结构的三种粒子An+1、Bn-和C,下列判断正确的是
| A.原子序数C>B>A | B.微粒半径An+1>Bn- |
| C.原子半径A<B | D.C是稀有气体元素的原子 |