已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,A对氢气的相对密度为14;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线 如下图所示。
如下图所示。

回答下列问题:
(1)A的相对分子质量为: ;结构简式为: 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:
① ,④ 。
(4)写出下列反应的化学方程式:
① ;
④ 。[来
已知A、B、C、D、E为中学化学常见的五种物质,均含元素R,R在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。常温下,A、B、C、D为气体,且D+H2O→C+E。
请回答下列问题:
⑴元素R在元素周期表中的位置为_____________; B分子的电子式为__________。
⑵已知气体D与NaOH溶液1:1恰好完全反应,生成R的两种含氧酸盐,所得溶液中各离子浓度大小关系。
⑶将22.4L某R的氧化物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体积均在相同条件下测定),则该氧化物的化学式可能为。(填序号)
①、RO2 ②、R2O3③、RO④、R2O
⑷科学家制备的另一种化合物,与A的组成元素相同,具有很高的热值,可用作火箭和燃料电池的燃料。该化合物可由次氯酸钠溶液和A反应得到,写出该反应的化学方程式。
⑸M为E的钠盐,一定条件下可发生如下反应: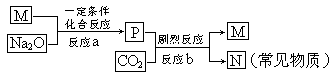
①设计实验方案,鉴定常见物质N。
②此外,科学家还制备了另一种钠盐X,其与P的组成元素完全相同,X中的阴离子与P中的阴离子表观形式相同(元素种类和原子个数均相同),但X中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,钠盐X的阴离子与水反应生成过氧化氢的离子方程式为。
| 25℃平衡体系(苯、水、HA) |
平衡常数 |
焓变 |
起始总浓度 |
在水中,HA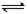 H++A- H++A- |
K1 |
△H1 |
3.0×10-3 mol·L-1 |
在苯中,2HA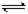 (HA)2 (HA)2 |
K2 |
△H2 |
4.0×10-3 mol·L-1 |
(本题共12分)
A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,按下列途径合成一种常见的医用胶(结构简式为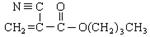 )
)
已知两个醛分子在一定条件下可以发生如下反应;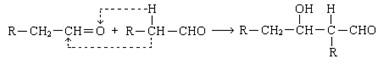
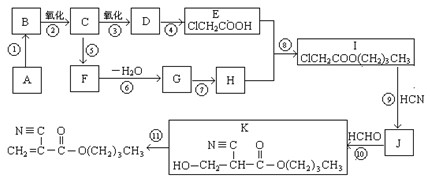
根据题意回答:
1.A的结构简式是_________________,D的官能团名称是。
2.⑥的反应条件是,I→J的另一生成物是。
3.属于取代反应的有(填反应序号)____________,⑩的反应类型是。
4.写出⑤的化学方程式:_____________________________________________________。
5.F有多种同分异构体,其中能够在NaOH溶液中发生反应的同分异构体有种。
6.如果以F为原料经过三步合成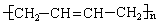 ,对应的反应类型分别为
,对应的反应类型分别为
。
(本题共8分)
已知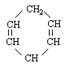 可简写为
可简写为 。现有某化合物W的分子结构可表示为
。现有某化合物W的分子结构可表示为 。根据题意回答:
。根据题意回答:
1.W属于
A.芳香烃 B.环烃 C.不饱和烃 D.炔烃
2.W的分子式为,它的一氯代物有种。
3.有关W的说法错误的是
A.能发生还原反应 B.能发生氧化反应
C.易溶于水 D.等质量的W与苯分别完全燃烧,前者消耗的氧气多
4.W有一种芳香族的同分异构体,该物质能在一定条件下发生聚合反应,相应的化学方程式为。
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
2.加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为。
3.滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有。
4.在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法。
5.已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤。“操作I”是将滤液继续蒸发浓缩,冷却结晶,,便得到了MgSO4·7H2O。
6.实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为。
(本题共8分)
NO和CO都是有毒的气体,利用催化技术能够将它们转变成无毒的CO2和N2。一定量的NO和CO进行如下反应:2NO+2CO 2CO2+N2,其部分化学平衡常数如下表:
2CO2+N2,其部分化学平衡常数如下表:
| T(℃) |
0 |
50 |
100 |
| K |
0.5 |
1.05 |
2.56 |
根据题意回答(均不考虑温度变化对催化剂催化效率的影响):
1.若把化学方程式写为NO+CO CO2+1/2N2,则100℃时,K的值=。
CO2+1/2N2,则100℃时,K的值=。
2.上述反应达到化学平衡后,下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
3.若上述反应在容积不变的密闭容器中进行,该可逆反应达到平衡的标志是____
A.气体的密度不再变化
B.单位时间内消耗的CO与生成的CO2的物质的量之比为1︰1
C.气体的压强不再变化
D.各气体的浓度相等
4.某温度下,将0.02 mol的NO和0.02 mol的CO的混合气体充入一装有催化剂的容器中,充分反应后,测得混合气体中CO的体积分数为0.125,则CO的转化率为。