工业上根据污水中所含物质或离子的不同,有多种处理方法,比如: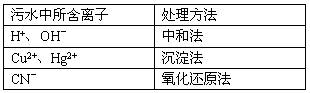
请回答:
(1)在中和法中,若用CO2来处理污水,则离子方程式是___________________________。
(2)在沉淀法中,用硫化钠作沉淀剂,能有效地处理含Cu2+、Hg2+等重金属离子的污水。若某污水中能与硫化钠反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入硫化钠________g(精确到0.1)
我国规定的排放标准不能超过0.05mg/L,若1L污水经过沉淀法处理后含Hg2+为2×10-7 mol,则该污水是否达到了排放标准_____________(填“是”或“否”)
(3)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,得到元素的CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式是__________________________________。
有A、B、C、D四种元素,A元素的原子得2个电子,B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数。C元素的原子只有1个电子,A、D两元素原子核外电子总数比B元素原子质子数多9个。试写出:
(1)A、C的元素符号分别为 、 。
(2)D原子的原子结构示意图为 ,B+的离子结构示意图 。
(1)设1个12C的质量是a kg,1个Na的质量是b kg,则Na的摩尔质量是 ;
(2)10.0g 由2H和16O组成的水分子,其中质子数___________
(3)标准状况下,11.2 L CO和CO2混合气体质量为20.4 g,则混合气体中CO和CO2的体积比为
(4)19 g 某二价金属的氯化物ACl2中含有0.4 molCl-,A的相对原子质量
(5)N2在标准状况下的密度为 g/L 。
有以下几种物质①干燥的食盐晶体②液态氯化氢③水银④蔗糖⑤CO2⑥KNO3溶液⑦氯气,填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;属于非电解质的是 ;
按要求填空
(1)Na3PO4在水溶液中的电离方程式:_____________________________
(2)氯气与水反应的化学方程式:________________________________
(3)工业上制取氯气的化学方程式为:____________________________
甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)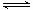 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)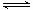 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断反应I为______热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
② 2CO(g)+ O2(g)= 2CO2(g) ΔH2 kJ/mol
③ H2O(g)= H2O(l) ΔH3 kJ/mol
则反应CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l)ΔH= kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2‾7)时,实验室利用下图装置模拟该法:
① N电极的电极反应式为 。
② 请完成电解池中Cr2O2‾7转化为Cr3+的离子反应方程式:
Cr2O7 2‾+ Fe2+ + [ ]═= Cr3++ Fe3++ H2O
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH= 。(已知, Ksp[Cr(OH)3]=6.4×10‾31,lg2=0.3)