著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。下列说法正确的是
A.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI  CeI4 + 2H2↑ CeI4 + 2H2↑ |
| B.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+ ="=" Ce3+ + 2Fe3+ |
| D.四种稳定的核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同系物 |
在恒温恒容的密闭容器中进行的气体反应:H2(g)+Br2(g)  2HBr(g),能说明反应已达平衡状态的是 ( )
2HBr(g),能说明反应已达平衡状态的是 ( )
| A.容器内混合气体颜色不随时间改变而改变 | B.H2、Br2的反应速率相等 |
| C.容器内的压强不随时间改变而改变 | D.混合气体的密度不随时间改变而改变 |
2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知碘盐的主要成分是KIO3和NaCl,KIO3与NaHSO3发生反应:2KIO3 + 6NaHSO3 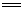 2KI + 3Na2SO4 + 3H2SO4,下列说法中不正确的是()
2KI + 3Na2SO4 + 3H2SO4,下列说法中不正确的是()
| A.23Na37Cl中质子数和中子数之比是7:8 | B.KIO3和NaHSO3都是强电解质 |
| C.KIO3作氧化剂发生氧化反应 | D.生成1mo1 KI时,转移6 mo1电子 |
在 0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述中,正确的是()
CH3COO-+H+,对于该平衡,下列叙述中,正确的是()
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.1 mol·L-1 HCl溶液,溶液中C(H+)减小 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
关于晶体的下列说法正确的是()
| A.在晶体中只要有阴离子就一定有阳离子 | B.在晶体中只要有阳离子就一定有阴离子 |
| C.原子晶体的熔点一定比金属晶体的高 | D.晶体中分子间作用力越大,分子越稳定 |
对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是()
| A.加入一种反应物 | B.增大体系的压强 | C.升高温度 | D.使用催化剂 |