铜的冶炼过程大致可分为:①富集,将硫化物矿进行浮选;②焙烧,主要反应为
2CuFeS2+4O2 ="=" Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为: 2Cu2S+3O2 ="=" 2Cu2O+2SO2;2Cu2O+Cu2S ="=" 6Cu+SO2↑;④电解精炼铜。下列说法不正确的是( )
| A.Cu2O是红色固体 |
| B.冶炼过程中的尾气可用来制硫酸 |
| C.上述过程中,由2 mol CuFeS2制取Cu时,最少消耗5.0mol O2 |
| D.电解精炼铜的开始阶段,每转移2mol电子时,阳极溶解铜的质量为64g |
某温度下,在容积固定的密闭容器中发生可逆反应:A(g)+2B(g)  2Q(g)。平衡时,各物质的浓度比为c(A)∶c(B)∶c(Q)=1∶1∶2。保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
2Q(g)。平衡时,各物质的浓度比为c(A)∶c(B)∶c(Q)=1∶1∶2。保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
A.刚充入时反应速率,v(正)减小,v(逆)增大
B.达到新的平衡时,反应混合物中A、B的物质的量分数增加
C.达到新的平衡时,c(A)∶c(B)∶c(Q)仍为1∶1∶2
D.达到新的平衡过程中,体系压强先增大,后逐渐减小
在一密闭容器中,发生反应:A(g)+B(g)  C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是
C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是
| T/℃ |
800 |
850 |
1 000 |
1 200 |
| K |
0.9 |
1.0 |
1.7 |
2.4 |
A.若A的浓度增加到原平衡的2倍,则平衡一定正向移动
B.该反应的ΔH>0
C.在850℃条件下,反应达到平衡时,容器中各物质的浓度一定相等
D.A的转化率越大,平衡常数越大
放热反应CO(g)+H2O(g)  CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
| A.K2和K1的单位均为mol·L-1 | B.K2>K1 |
| C.c2(CO)=c2(H2O) | D.c1(CO)>c2(CO) |
将NO2装入带活塞的密闭容器中,当反应2NO2(g)  N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
| A.升高温度,气体颜色加深,则此反应为吸热反应 |
| B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅 |
| C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍 |
| D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅 |
已知Na2S2O3+H2SO4═Na2SO4+SO2 +SO2
+SO2 +H2O下列各组实验中溶液最先变浑浊的是
+H2O下列各组实验中溶液最先变浑浊的是
| 组号 |
参加反应的物质k.Com] |
|||||
| 反应温度(℃) |
 |
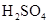 |
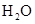 |
|||
| V(mL) |
C(mol/L) |
V(mL) |
C(mol/L) |
V(mL) |
||
| A |
10 |
5 |
0.1 |
5 |
0.1 |
5 |
| B |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
| C |
30 |
5 |
0.2 |
5 |
0.2 |
5 |
| D |
30 |
5 |
0.2 |
5 |
0.2 |
10 |