对于反应:C(S)+H2O(g)=CO(g)+H2(g),△H>0,为了提高C(S)的转化率,可采取的措施是
| A.多加入C(S) | B.升高反应温度 | C.增大压强 | D.使用催化剂 |
已知 ①丙烷②正丁烷③异丁烷④2-甲基丁烷⑤己烷,上述物质的沸点按由低到高的顺序排列的是()
①丙烷②正丁烷③异丁烷④2-甲基丁烷⑤己烷,上述物质的沸点按由低到高的顺序排列的是()
| A.①③②④⑤ | B.⑤④③②① | C.①②③④⑤ | D.⑤①②④③ |
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是()
| A.利用金属钠或者金属钾 | B.利用红外光谱法 |
| C.利用质谱法 | D.利用核磁共振氢谱 |
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为()
| A.(a+3b)mol | B.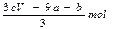 |
C.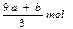 |
D.(cV-3a-9b)mol |
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是() 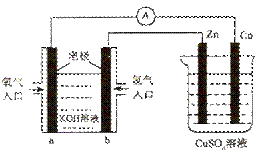
| A. | 该装置中Cu极为正极 |
| B. | 当铜极的质量变化为12.8g时,a极上消耗的O 2在标准状况下的体积为2.24L |
| C. | b极反应的电极反应式为:H 2-2e -=2H + |
| D. | 一段时间后锌片质量减少 |
下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是() 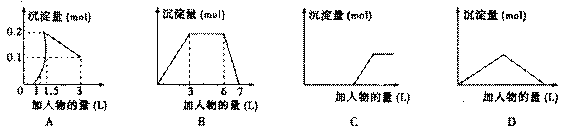
| A. | 向1L浓度均为0.1mol/L的Ba(OH) 2、NaAlO 2混合液中加入0.1 mol/L稀H 2SO 4溶液 |
| B. | 向含有0.1 mol/L AlCl 3和0.3mol/L NH 4Cl的1L混合液中加入0.1mol/LNaOH溶液 |
| C. | 向烧碱溶液中滴加明矾溶液 |
| D. | 向Ba(OH) 2溶液中逐渐通入二氧化碳 |