已知F为高分子化合物: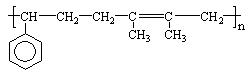
C分子结构中只含有一种氢。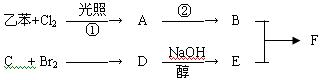
(1)写出下列物质结构简式
A: C: E:
(2)判断①反应类型:
(3)写出②反应进行所需条件:
(4)写出C7H80所有含苯环结构的同分异构体:(提示:5种同分异构体)
工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步,如果直接调整pH=9.6,不能将Cu2+和Fe2+分离除去,理由是:___________。现有下列几种常用的氧化剂,可用于氧化除去混合溶液中Fe2+,其中最好选:________。
①KMnO4 ②H2O2 ③NaClO ④浓HNO3
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________。
①Cu(OH)2 ②氨水 ③Cu2(OH)2CO3 ④NaOH
(3)直接加热溶液,蒸干______(选填“能”或“不能”)得到氯化铜晶体(CuCl2·2H2O)。
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=____mol/L,反应开始前容器中的A、B的物质的量:n(A)= n(B)=______mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1) 在这些元素中,化学性质最不活泼的是:_____________ (填具体元素符号,下同)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3) 最高价氧化物是两性氧化物的元素是___________;写出它的氧化物与氢氧化钠反应的离子方程式________________________。
(4) 用电子式表示元素④与⑥形成的的化合物的形成过程______________________ ,该化合物属于__________________(填 “共价”或“离子”)化合物。
(5)元素①与⑦形成的的化合物的电子式为__________________,该化合物是由___________ (填“极性”“非极性”)键形成的。
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_______________________,发生反应(填氧化或还原);电子从经外电路到____(填锌或铜),溶液中H+ 向移动(填正极或负极),放电一段时间后,正极区pH值(填变大、变小或不变)。
(2)将铜片和铁片用导线连接后插入三氯化铁溶液中,也有电流通过电流表,负极电极反应式为_________________,总反应的离子方程式为______。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为__________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是,(填氢化物化学式),原因是;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本题涉及的含C元素的物质均易溶于水): 。