工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室 用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)  4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =" 571.2" kJ·mol-1 ①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s) △H2=" 226.2" kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=" 226.2" kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
(2)反应C(s) + CO2(g)  2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
(3)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
①下列措施中,有利于降低大气中CO2浓度 的有: 。(填字母)
的有: 。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
②将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O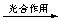 C6H12O6 b.CO2 + 3H2
C6H12O6 b.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4 CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2 CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是 ,原子利用率最高的是 。
针对以下①~④四个涉及H2O2的反应(未配平),填写空白:
①Na2O2+HCl——H2O2+NaCl
②Ag2O+H2O2——Ag+O2↑+H2O
③H2O2——H2O+O2↑
④H2O2+Cr2(SO4)3+KOH——K2CrO4+K2SO4+H2O
(1)H2O2仅体现氧化性的是 (填代号,下同),该反应配平的方程式为 。
(2)H2O2既体现氧化性又体现还原性的是 。
(3)H2O2仅体现弱酸性的反应是,其理由为 。
常温下,将Fe粉和S粉混合,不发生反应。某课外活动小组将Fe粉和S粉按物质的量比1∶1混合均匀,并置于水平放置且隔绝空气的玻璃管中,加热片刻,反应开始,然后撤去酒精灯,发现反应仍能剧烈进行,并使生成的固体呈红热状态。试完成下列问题:
(1)上述现象说明了_____________________________。
(2)将生成的黑色固体置于稀H2SO4中,有气体放出,写出发生反应的离子方程式__________________________________________________________。
(3)已知H2S是一种剧毒、有刺激性气味的气体,试说明实验室制取H2S时应采用的一条安全措施___________________________。
(4)将21.0 g铁粉(过量)和硫粉混合,在隔绝空气情况下加热,将反应后的全部物质装入到足量的稀盐酸中,则生成气体的体积为____________(标准状况)。
假设116号元素存在,完成下列问题:
(1)116号元素在元素周期表中的位置是___________________________________。
(2)下列关于116号元素的说法中正确的是_________________。
A.无氧酸钠盐的化学式为Na2R的形式
B.最高价氧化物可能是碱性氧化物
C.原子的近似相对原子质量必定为332
硫通常是一种淡黄色的晶体。有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示。对这三种硫蒸气测定的结果是:①橙色蒸气的密度折算成标准状况后是11.43g·L-1,则它的化学式是;②红棕色蒸气的质量是相同状况时同体积空气的6.62倍,则它的化学式为;③无色蒸气对氢气的相对密度是64,则它的化学式是。此事实说明:硫有。
臭氧能与KI溶液反应,生成一种可使带火星的木条复燃的气体。向反应后的溶液中滴入酚酞,溶液变红色;若滴入淀粉溶液,则变为蓝色。为测定大气中臭氧的含量,将0℃101kPa下33.6m3的空气通入KI溶液,使之完全反应。在所得溶液中用0.01mol·L-1的Na2S2O3溶液60mL恰好与之反应完全(反应式为2Na2S2O3+I2  Na2S4O6+2NaI)。
Na2S4O6+2NaI)。
(1)完成下列化学方程式:
O3+KI+H2O——
(2)计算大气中臭氧的体积分数。