对CH4与Cl2的反应(如图所示)叙述不正确的是
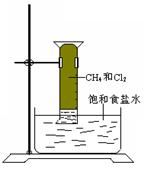

A.该反应属于取代反应 |
B.该反应的条件是光照 |
C.该反应的生成物有四种 |
D.该反应的现象是量筒内气体颜色变浅,器壁上有油状 液滴,量筒内液面上升并产生白雾 液滴,量筒内液面上升并产生白雾 |
下列有关物质分类正确的是
| A.CuO、MgO、Na2O2均属于碱性氧化物 |
| B.次氯酸、醋酸、氨气均属于弱电解质 |
| C.C60、CCl4、蛋白质均属于有机物 |
| D.液氯、晶体硅、臭氧均属于单质 |
在某K2SO4和Fe2(SO4)3的混合溶液中,Fe3+摩尔浓度为0.1摩/升,SO42-摩尔浓度为0.3摩/升,则K+的物质的量浓度为( )摩/升.
| A.0.6 | B.0.3 | C.0.2 | D.0.15 |
13.9g XSO4·nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子量为
| A.23 | B.27 | C.40 | D.56 |
欲从溶有苯酚的乙醇中回收苯酚,有下列操作:
①蒸馏 ②过滤 ③静置分液④加入足量的金属钠⑤通入过量的二氧化碳
⑥加入足量的NaOH溶液⑦加入足量的浓溴水 ⑧加入硫酸与NaBr共热.最合理的操作顺序是
| A.④⑤③ | B.⑥①⑤③ | C.⑦② | D.⑧③ |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.2NA |
| B.1 mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA |
| C.常温常压下,1.7 g H2O2中含有的电子数为NA |
| D.标准状况下,1 mol CO2所含共用电子对数为2NA |