某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
| A.Mg2+、Cl-、Na+、NO3- | B.K+、Na+、NO3-、HCO3- |
| C.Na+、Ba2+、Cl-、NO3- | D.Fe3+、Na+、AlO2-、SO42- |
在一密闭容器中进行如下可逆反应H2(g)+I2(g) 2HI(g),达到平衡时,下列有关说法不正确的是
2HI(g),达到平衡时,下列有关说法不正确的是
| A.恒温加压,该化学平衡一定不移动 |
| B.其它条件不变,当加入与初始投入量相同量的氢气和碘蒸气,达到平衡后HI的百分含量增大 |
| C.升温,此化学平衡肯定会发生移动 |
| D.在原平衡基础上,恒容,充入氢气,达到新平衡时逆反应速率也会增大 |
下列离子方程式正确的是
A.用两个铜电极电解稀盐酸:2H+ + 2Cl- H2↑ + Cl2↑ H2↑ + Cl2↑ |
| B.向Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀AlO2- +HCO3- +H2O = Al(OH)3↓ + CO2 |
| D.向Na2FeO4溶液中加入稀硫酸,迅速反应产生Fe2(SO4)3: |
4FeO42-+20 H+=4Fe3++3O2↑+10H2O
某药物分子结构简式如下图所示,下列关于该物质的说法不正确的是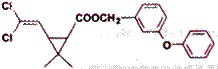
| A.分子式为C21H20O3Cl2 |
| B.醚键上的氧原子至少与另外11个原子共面 |
| C.分子中不存在手性碳原子 |
| D.在一定条件下可发生加成、取代、氧化反应 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA |
| B.常温下,1 molO2和O3的混合气体中所含氧原子数为2.5NA |
| C.标准状况下,11.2 L的乙烯中含有的共用电子对数为NA |
| D.13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA |
化学与科学、技术、社会、环境密切相关。下列说法不正确的是
| A.SiC的硬度很大,可用作砂纸、砂轮的磨料 |
| B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| C.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 |
| D.过氧化钠能与二氧化碳反应产生氧气,可用作高空飞行或潜水的供氧剂 |