下列反应的离子方程式正确的是( )
| A.铝粉投入到NaOH溶液中:2Al +2OH- = 2AlO2- + H2↑ |
| B.铁粉加入三氯化铁溶液中:2Fe +Fe3+ = 3Fe2+ |
| C.AlCl3溶液中加入足量的氨水:Al3+ + 3OH- = Al(OH)3↓ |
| D.FeCl2溶液中加入氯水:Cl2 +2 Fe2+ ="2" Fe3+ + 2Cl- |
常温下,pH=10的X、Y两种碱溶液各1 mL,分别稀释至100 mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是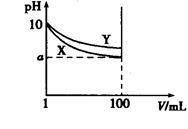
| A.X、Y两种碱溶液中溶质的物质的量浓度一定相等 |
| B.稀释后,X溶液的碱性比Y溶液的碱性强 |
| C.分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积Vx>Vy |
| D.若8<a<10,则X、Y都是弱碱 |
液氨与水性质相似,也存在微弱的电离:2NH3 NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
NH4++NH2-,其离子积常数K=c(NH4+)·c(NH2-)=2×l0-30,维持温度不变,向液氨中加入少量NH4Cl固体或NaNH2固体,不发生改变的是
| A.液氨的电离度 | B.液氨的离子积常数 |
| C.c(NH4+) | D.c(NH2-) |
用石墨作电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合液中Cu2+ 的物质的量浓度为
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
根据热化学方程式:S(s)+O2(g) 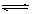 SO2(g);△H =—297.23 kJ. mol—1,分析下列说法正确的是
SO2(g);△H =—297.23 kJ. mol—1,分析下列说法正确的是
A.S(g)+O2(g) SO2(g) ;△H=Q,Q值大于297.23 kJ. mol—1 SO2(g) ;△H=Q,Q值大于297.23 kJ. mol—1 |
B.2S(g)+ 2O2(g) 2SO2(g);△H=—594.46 kJ. mol—1 2SO2(g);△H=—594.46 kJ. mol—1 |
C.SO2(g) S(g)+O2(g);△H=Q,Q值为负值,其绝对值小于297.23 kJ. mol—1 S(g)+O2(g);△H=Q,Q值为负值,其绝对值小于297.23 kJ. mol—1 |
D.SO2(g) S(g)+O2(g) ;△H=Q,Q值为正值,其绝对值大于297.23 kJ. mol—1 S(g)+O2(g) ;△H=Q,Q值为正值,其绝对值大于297.23 kJ. mol—1 |
已知某可逆反应:mA(g)+nB(g) pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g);△H 在密闭容器器中进行,如图所示,反应在不同时间t,温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
| A.T1<T2,P1>P2,m+n>p,△H>0 |
| B.T1>T2,P1<P2,m+n<p,△H>0 |
| C.T1>T2,P1<P2,m+n<p,△H<0 |
| D.T1>T2,P1>P2,m+n>p,△H<0 |