某高分子材料的结构如右图,则其对应的单体的结构简式为:______________________,______________________。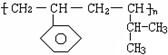
标准状况下有①9.03×1023个NH3分子。②44.8L CH4③85g H2S气体
下列对这三种气体的关系从大到小的顺序是:
(1)物质的量(2)质量
(3)原子总数(4)密度
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是(填元素符号),e的价层电子排布式为。
(2)a和上述元素中的一种元素形成的共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;上述元素形成的分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式)。
(3)这些元素形成的含氧酸中,酸根中的中心原子的价层电子对数为3的酸是;酸根呈三角锥形结构的酸是。(均填化学式)
(4)e和c形成的一种离子化合物的晶体的晶胞结构(图1),则e的化合价为。
(5)这5种元素形成的一种阴阳离子数比为1:1的离子化合物中,阴离子呈四面体结构;阳离子呈狭长的八面体结构(图2)。该化合物中阴离子为,阳离子中存在的化学键类型有。
(6)根据e晶胞结构(图3),e晶胞中每个e原子周围距离最近的e原子数目为。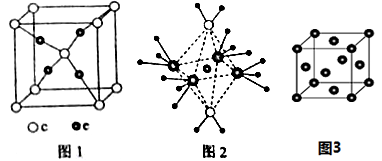
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)卤族元素位于周期表的_________区;溴的电子排布式为______________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是。
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是。
| 氟 |
氯 |
溴 |
碘 |
铍 |
|
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4(填“>”、“<”或“=”)
(5)已知ClO2-立体构型为V型。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的化学式__________(写出1个)
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。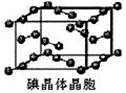
A、用均摊法可知平均每个晶胞中有4个碘原子
B、碘晶体为无限延伸的空间结构,是原子晶体
C、碘晶体中存在非极性键和范德华力
下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
(1)10种元素中,第一电离能最大的是______(填元素符号);电负性最小的金属是(填元素符号)。
(2) ①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是______________________(填化学式)。
(3) ②、③、④三种元素可形成的离子,离子半径由大到小的顺序为____________________(填离子符号)。
(4) ①和⑨两元素形成化合物的化学式为,该化合物灼烧时的焰色为
色;该化合物的溶液与元素⑧的单质反应的离子方程式为
(5) 用电子式表示第三周期元素中电负性最小的元素和电负性最大的元素形成化合物的过程。
现有下列物质:
①金刚石②干冰③氯化铵④氖⑤金属锌⑥石英⑦硫化氢
(1)通过非极性键形成原子晶体的是;属于分子晶体,且分子为直线型的是;由单原子分子构成的分子晶体是;含有极性键的离子化合物是;能导电且为金属晶体的是。(均填序号)
(2)有下列粒子:
①CCl4 ②SO3③P4④H3O+⑤CO32-⑥PH3
其中属于非极性分子的是;粒子立体构型为平面三角形的是;粒子立体构型为三角锥形的是;粒子立体构型为四面体的是。(均填序号)
(3)某+3价离子的电子排布式为1s22s22p63s23p63d5,则该元素在周期表中的位置是在周期族,画出该元素的原子结构示意图。