一定条件下,在某密闭容器中,有下列可逆反应:
2X(g)+Y(g) 2Z(g);△H<0,下列有关该反应的说法中
2Z(g);△H<0,下列有关该反应的说法中 正确的是 ( )
正确的是 ( )
| A.该反应的正反应为吸热反应 |
| B.当各物质浓度不再变化时,反应达到平衡状态 |
| C.若温度不变,平衡后把容器的体积增大一倍,平衡将不移动 |
| D.若升高温度,平衡向正反应的方向移动 |
用铂电极电解CuCl2与CuSO4的混合溶液(浓度均为2 mol/L)50 mL,当阴极析出9.6 g固体时,标准状况下阳极得到的气体的体积是
| A.3.36 L | B.2.8 L | C.6.72 L | D.4.48 L |
由化学能转变的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是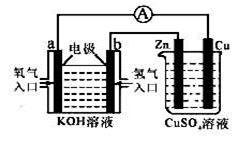
| A.该装置中铜为阳极 |
| B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L |
| C.该装置中b极的电极反应式是:H2+2OH--2e-== 2H2O |
| D.该装置中a极为正极,发生氧化反应 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为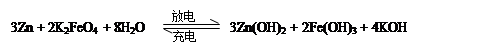
下列叙述不正确的是
| A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 |
| B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO42—+ 4H2O |
| C.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2 |
| D.放电时正极附近溶液的碱性增强 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
关于如图所示装置的叙述,正确的是
| A.铜是阳极,铜片上有气泡产生 | B.铜片质量逐渐减少 |
| C.电流从锌片经导线流向铜片 | D.铜离子在铜片表面被还原 |