下列四种气体(括号内是混有的少量杂质),其中可用下图所示仪器装置进行净化和干燥的气体 ( )
| A.CO2(HCl) | B.N2(SO2) | C.CO2(SO2) | D.NH3(N2) |
下列电离方程式中正确的是
A.NaHSO4溶于水:NaHSO4 Na++H++SO42- Na++H++SO42- |
| B.次氯酸电离:HClO===ClO-+H+ |
C.HF溶于水:HF+H2O H3O++F- H3O++F- |
D.NH4Cl溶于水:NH4++H2O NH3·H2O+H+ NH3·H2O+H+ |
工业生产水煤气的反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
CO(g)+H2(g) ΔH=+131.4kJ·mol-1下列判断正确的是
| A.水煤气反应中,生成1molH2(g)吸收131.4 kJ热量 |
B.CO(g)+H2(g) C(s)+H2O(g)ΔH=+131.4kJ·mol-1 C(s)+H2O(g)ΔH=+131.4kJ·mol-1 |
| C.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
| D.反应物能量总和大于生成物能量总和 |
在298K、101kPa时,已知:
(1)2H2O(g)= O2(g)+2H2(g) ΔH1
(2)Cl2(g)+H2(g)=2HCl(g) ΔH2
(3)2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
某化学反应的能量变化如图所示。下列有关叙述正确的是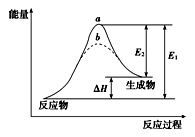
| A.逆反应的活化能小于正反应的活化能 |
| B.a、b分别对应有催化剂和无催化剂的能量变化 |
| C.该反应的反应热ΔH=E2-E1 |
| D.催化剂能改变反应的焓变 |
下列说法或表示法正确的是
| A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 |
| B.需要加热的反应说明它是吸热反应 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3kJ |
| D.1molS完全燃烧放热297.3kJ,热化学方程式为:S+O2 =SO2 ΔH=-297.3kJ·mol-1 |