不久前,日本某一材料研究所的科学家发明了一种“碳纳米管温度计”,这种温度计被认定为世界上最小的温度计。研究人员在长约10-6m,直径为10-7m的碳纳米管中充人液态的金属镓。当温度升高时,管中的镓就会膨胀,通过电子显微镜就能读取温度值。这种温度计测量的范围可从18℃到490℃,精确度较高,所以它可用于检查电子线路是否异常,测定毛细血管的温度等许多方面。根据以上信息判断下列推测中正确的是
| A.碳纳米管的体积在10℃至500℃之间随温度变化很小,可忽略不计 |
| B.金属镓的熔点、沸点都很低 |
| C.金属镓的体积在10℃至500℃之间随温度变化比较均匀 |
| D.金属镓的体积在10℃至500℃之间随温度变化很小,可忽略不计 |
下列离子方程式正确的是
A.钠投入到水中2Na+2H2O 2Na++2OH-+H2↑ 2Na++2OH-+H2↑ |
B.氯化铵溶液与浓NaOH溶液加热NH4++OH- NH3·H2O NH3·H2O |
C.氯化铝溶液中滴入过量氨水Al3++3NH3·H2O Al(OH)3↓+3NH4+ Al(OH)3↓+3NH4+ |
D.铁片插入氯化铁溶液中Fe+Fe3+ 2Fe2+ 2Fe2+ |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
常温下,下列各组离子在指定溶液中可能大量共存的是
| A.FeCl3溶液中:K+、Na+、SO42-、SCN- |
| B.使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- |
| C.漂白粉溶液中:K+、Na+、I-、CO32- |
| D.与铝反应产生氢气的溶液中:Na+、K+、CO32-、OH- |
下列开发利用自然资源制取化学品,其简示途径较为合理的是
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随加入氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为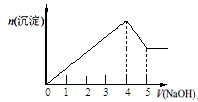
| A.2∶1 | B.4∶1 | C.1∶1 | D.1∶2 |