(12分)工业上从铝土矿(含氧化铝、氧化铁等)制取铝的流程如图所示:
经分析,生产原料(铝土矿)和提取Al2O3后的残渣(赤泥)的部分成分见下表(以氧化物表示)且已知铝土矿中的Fe2O3全部转入赤泥。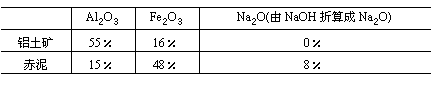
(1)生产中每消耗1t铝土矿将产生多少吨赤泥?
(2)试计算出每炼1t铝,理论上需要多少吨铝土矿?
在1911年前后,新西兰出生的物理学家——卢瑟福把一束变速运动的α粒子(质量数为4的带2个正电荷的质子粒),射向一片极薄的金箔,他惊奇地发现,过去一直认为原子是“实心球”,而由这种“实心球”紧密排列而成的金箔,竟让大多数α粒子畅通无阻地通过,就像金箔不在那儿似的,但也有极少量的α粒子发生偏转,或被笔直地弹回。根据以上叙述的实验现象能得出关于金箔中Au原子结构的一些结论,试写出其中的三点。
A.______________________________;
B.______________________________;
C.______________________________。
有A、B、C三种元素,其核电荷数之和为32,A为原子核内有12个中子的金属元素,形成化合物时显+2价,当2.4 g单质A与足量稀硫酸反应时,产生2.24 L H2(标准状况)。B有两个电子层,且各电子层的电子数与电子层总数相等。
(1)写出元素A、B、C的名称及元素符号:A_____,B_____,C_____。
(2)A2+、B、C2-的结构示意图分别是________,________,________。
下列粒子中:(其中P表示质子,n表示中子,e-表示电子)
| A.12P,12n,10e- | B.14P,14n,14e- |
| C.17P,18n,17e- | D.17P,20n,17e- |
E.17P,18n,18e- F.17P,20n,18e-
属于原子的是_____(填编号,下同);属于阳离子的是____;属于阴离子的是____;属于同一种元素的粒子是____。
填写下列符号中“2”的含义。
(1)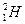 _______________________________。
_______________________________。
(2)H2_________________________________。
(3)Ca2+________________________________。
(4) _______________________________。
_______________________________。
(5)2He________________________________。
(6)2Cl________________________________。
完成下面表格: