下列实验用来证明SO2的存在,其中正确的是( )
| A.能使品红褪色,加热后又出现红色 |
| B.能使湿润的蓝色石蕊试纸变红 |
| C.通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 |
| D.通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸 |
某种聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6===6C+LiCoO2,其电池如图所示。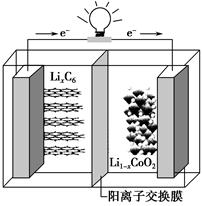
下列说法不正确的是
| A.放电时,LixC6发生氧化反应 |
| B.充电时,Li+通过阳离子交换膜从左向右移动 |
| C.充电时将电池的负极与外接电源的负极相连 |
| D.放电时,电池的正极反应为Li1-xCoO2+xLi++xe-===LiCoO2 |
火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2=Cu2S+2FeS+SO2则下列说法正确的是
| A.CuFeS2仅作还原剂,硫元素被氧化 |
| B.每生成1mol Cu2S,有4 mol硫被氧化 |
| C.SO2只是氧化产物,FeS只是还原产物 |
| D.每转移1.2 mol电子,有0.2mol硫被氧化 |
常温下,有关醋酸溶液的叙述中正确的是
| A.用pH 计测得0.1 mol·L-1的CH3COOH溶液的 pH约2.9,说明CH3COOH是弱酸 |
B.将pH=3的醋酸稀释为pH=4的过程中,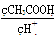 比值不变 比值不变 |
| C.向0.1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,CH3COOH和H2O的电离程度都减小 |
| D.pH=3的醋酸和盐酸分别与pH=11的NaOH溶液完全中和,两者消耗NaOH溶液的体积相同 |
短周期元素W、X、Y、Z的原子序数依次增大,W、X的最外层电子数之比为4︰3,Y原子的最外层电子数是次外层电子数的一半,Z元素原子的半径在同周期元素原子中最小。下列叙述正确的是
| A.W、X、Y的最高价氧化物都能与NaOH溶液反应,它们都属于酸性氧化物 |
| B.W、Y、Z三种元素简单气态氢化物的热稳定性为: Z>W>Y |
| C.Z元素最高价氧化物对应的水化物的化学式为HZO3 |
| D.原子半径的大小顺序为:rY>rW>rX |
在下述条件下,一定能大量共存的离子组是
| A.无色透明的水溶液中:K+、Ba2+、Cl-、MnO4- |
| B.含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO32-、Br- |
| D.强碱性溶液中:ClO-、S2-、HSO3-、Na+ |