Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯, 等观察到 ,再点燃另一酒精灯。这样做的目的是 。
等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反 应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M
应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M g和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
g和Mg(OH)2 任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
某研究性学习小组利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数。下图是测定装置的示意图,A中的试剂是盐酸。
请回答下列问题。
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是;
(2)试剂C是水,其作用是____;
(3)试剂D是____,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是___(填下列操作序号)
①检验氢气纯度;②加热E;③检验装置气密性;④点燃G管溢出的气体;⑤从A瓶逐滴滴加液体
(5)已知:C(s)+1/2O2( g)= CO(g)△H=-110.5kJ·mol-1,
Cu2O(s) +1/2O2(g) = 2CuO(s)△H=-145 kJ·mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式:____。
实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。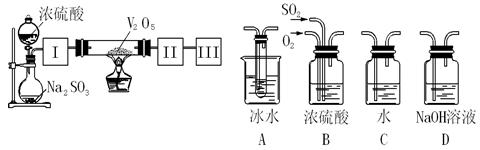
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ,装置Ⅱ,装置Ⅲ。
(3)开始进行实验时,首先应进行的操作是。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会(填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是(用含字母的代数表示)。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是。
(2)操作II中,通入硫化氢至饱和的目的是;在溶液中用硫酸酸化至pH=2的目的是。
(3)操作IV的顺序依次为:、冷却结晶、。
(4)测定绿矾产品中Fe2+ 含量的方法是:
a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol∙L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①已知KMnO4酸性溶液与Fe2+ 反应时被还原为Mn2+,请写出该反应的离子方程式:;
②计算上述样品中FeSO4∙7H2O的质量分数为(用小数表示,保留三位小数)。
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I- 能被NO3- 氧化成IO3-,被H2O2或O2等氧化为I2;② IO3- 能被HSO3- 还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3- 中的哪一种。
限选试剂如下:1.0 mol∙L-1HNO3溶液、1.0 mol∙L-1H2SO4溶液、1.0 mol∙L-1NaHSO3溶液、3%H2O2溶液、1%淀粉溶液、蒸馏水。
(1)提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3:。
(2)设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表:
| 实验步骤 |
预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡 |
若溶液显(填颜色),则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: |
若溶液显蓝色,则假设2成立,反应的离子方程式为;否则,假设2不成立,再进行步骤3 |
| 步骤3: |
(3)问题与思考
纯KIO3或纯KI都可以作为食用加碘盐中碘的来源。从化学角度来看,实验中添加(填“KIO3”或“KI”)更好,理由是。
Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是(填序号)
| 序号 |
A |
B |
C |
| 装置 |
 |
 |
 |
| 原理 |
通入V升空气,测定生成沉淀的质量 |
当KMnO4溶液刚好褪色时,测定通入空气的体积V |
通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。
(1)如上图连接好装置。实验前应进行操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1:;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
| 实验步骤 |
预期现象和结论 |
Fe(NO3)3溶液